Autora:
Helen Garcia
Data De La Creació:
21 Abril 2021
Data D’Actualització:
1 Juliol 2024
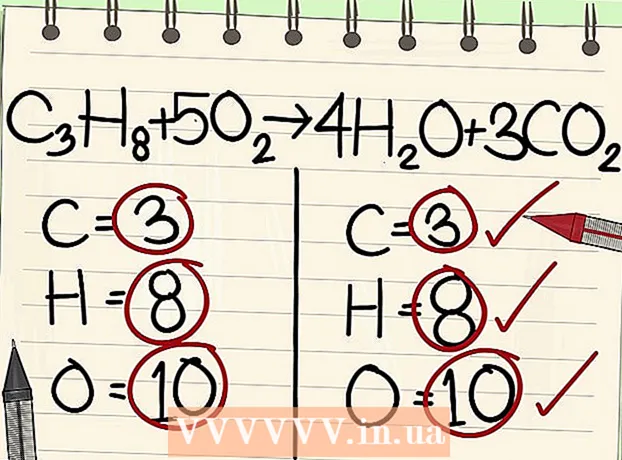
Content
Una equació química és una representació simbòlica d’una reacció química. En aquest cas, els compostos que reaccionen (reactius) s’escriuen a l’esquerra i les substàncies resultants (productes de reacció), a la part dreta de l’equació. Es col·loca una fletxa entre elles d’esquerra a dreta, que indica la direcció de la reacció. Segons la llei de conservació de la massa, en el transcurs d’una reacció química no poden aparèixer nous àtoms ni desapareixen els antics; per tant, el nombre d’àtoms dels reactius ha de ser igual al nombre d’àtoms dels productes de la reacció química. . Aquest article descriu com equilibrar equacions químiques mitjançant diferents mètodes.
Passos
Mètode 1 de 2: Mètode tradicional
 1 Anota una equació química. Com a exemple, tingueu en compte la reacció següent:
1 Anota una equació química. Com a exemple, tingueu en compte la reacció següent: - C3H8 + O2 -> H2O + CO2
- Aquesta reacció descriu la combustió del propà (C3H8) en presència d’oxigen per formar aigua i diòxid de carboni (diòxid de carboni).
 2 Anoteu el nombre d’àtoms de cada element. Feu això pels dos costats de l'equació. Tingueu en compte els subíndexs al costat de cada element per determinar el nombre total d’àtoms. Anoteu el símbol de cada element a l’equació i anoteu el nombre d’àtoms corresponent.
2 Anoteu el nombre d’àtoms de cada element. Feu això pels dos costats de l'equació. Tingueu en compte els subíndexs al costat de cada element per determinar el nombre total d’àtoms. Anoteu el símbol de cada element a l’equació i anoteu el nombre d’àtoms corresponent. - Per exemple, a la part dreta de l’equació considerada, com a resultat de l’addició, obtenim 3 àtoms d’oxigen.
- Al costat esquerre, tenim 3 àtoms de carboni (C3), 8 àtoms d’hidrogen (H8) i 2 àtoms d’oxigen (O2).
- A la part dreta tenim 1 àtom de carboni (C), 2 àtoms d’hidrogen (H2) i 3 àtoms d’oxigen (O + O2).
 3 Estalvieu hidrogen i oxigen per a més endavant, ja que formen part de diversos compostos als costats esquerre i dret. L’hidrogen i l’oxigen formen part de diverses molècules, per la qual cosa és millor equilibrar-les per últim.
3 Estalvieu hidrogen i oxigen per a més endavant, ja que formen part de diversos compostos als costats esquerre i dret. L’hidrogen i l’oxigen formen part de diverses molècules, per la qual cosa és millor equilibrar-les per últim. - Abans d’equilibrar l’hidrogen i l’oxigen, haureu de tornar a explicar els àtoms, ja que poden ser necessaris factors addicionals per equilibrar altres elements.
 4 Comenceu per l'element menys freqüent. Si necessiteu equilibrar diversos elements, trieu-ne un que formi part d’una molècula de reactiu i d’una molècula de productes de reacció. Per tant, primer s’ha d’equilibrar el carboni.
4 Comenceu per l'element menys freqüent. Si necessiteu equilibrar diversos elements, trieu-ne un que formi part d’una molècula de reactiu i d’una molècula de productes de reacció. Per tant, primer s’ha d’equilibrar el carboni.  5 Per obtenir un equilibri, afegiu un factor davant d’un únic àtom de carboni. Poseu un factor davant del carboni únic al costat dret de l’equació per equilibrar-lo amb 3 carbonis al costat esquerre.
5 Per obtenir un equilibri, afegiu un factor davant d’un únic àtom de carboni. Poseu un factor davant del carboni únic al costat dret de l’equació per equilibrar-lo amb 3 carbonis al costat esquerre. - C3H8 + O2 -> H2O + 3CO2
- Un factor de 3 davant del carboni al costat dret de l’equació indica que hi ha tres àtoms de carboni, que corresponen als tres àtoms de carboni de la molècula de propà al costat esquerre.
- En una equació química, podeu canviar els coeficients davant d’àtoms i molècules, però els subíndexs han de romandre invariables.
 6 Després equilibra els àtoms d’hidrogen. Després d’igualar el nombre d’àtoms de carboni als costats esquerre i dret, l’hidrogen i l’oxigen es van mantenir desequilibrats. El costat esquerre de l’equació conté vuit àtoms d’hidrogen, el mateix nombre hauria d’estar a la dreta. Aconsegueix-ho amb una proporció.
6 Després equilibra els àtoms d’hidrogen. Després d’igualar el nombre d’àtoms de carboni als costats esquerre i dret, l’hidrogen i l’oxigen es van mantenir desequilibrats. El costat esquerre de l’equació conté vuit àtoms d’hidrogen, el mateix nombre hauria d’estar a la dreta. Aconsegueix-ho amb una proporció. - C3H8 + O2 -> 4H2O + 3CO2
- Hem afegit un factor de 4 a la dreta, ja que el subíndex mostra que ja tenim dos àtoms d’hidrogen.
- Si multipliqueu el factor 4 pel subíndex 2, obtindreu 8.
- Com a resultat, s’obtenen 10 àtoms d’oxigen al costat dret: 3x2 = 6 àtoms en tres molècules de 3CO2 i quatre àtoms més en quatre molècules d’aigua.
 7 Equilibri els àtoms d’oxigen. Recordeu tenir en compte els coeficients que heu utilitzat per equilibrar els altres àtoms. Com que heu afegit els coeficients davant de les molècules a la part dreta de l’equació, el nombre d’àtoms d’oxigen va canviar. Ara teniu 4 àtoms d’oxigen en molècules d’aigua i 6 àtoms d’oxigen en molècules de diòxid de carboni. Per tant, hi ha 10 àtoms d’oxigen al costat dret.
7 Equilibri els àtoms d’oxigen. Recordeu tenir en compte els coeficients que heu utilitzat per equilibrar els altres àtoms. Com que heu afegit els coeficients davant de les molècules a la part dreta de l’equació, el nombre d’àtoms d’oxigen va canviar. Ara teniu 4 àtoms d’oxigen en molècules d’aigua i 6 àtoms d’oxigen en molècules de diòxid de carboni. Per tant, hi ha 10 àtoms d’oxigen al costat dret. - Afegiu un factor de 5 a la molècula d’oxigen a la part esquerra de l’equació. Ara cada peça conté 10 àtoms d’oxigen.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Per tant, els dos costats de l’equació contenen el mateix nombre d’àtoms de carboni, hidrogen i oxigen. L’equació és equilibrada.
Mètode 2 de 2: Mètode algebraic
- 1 Anota l’equació de reacció. Com a exemple, considerem la següent reacció química:
- PCl5 + H2O -> H3PO4 + HCl
- 2 Poseu una lletra davant de cada connexió:
- aPCl5 + bH2O -> cH3PO4 + dHCl
- 3 Igualar el nombre d’àtoms de cada element als costats esquerre i dret de l’equació.
- aPCl5 + bH2O -> cH3PO4 + dHCl
- A l’esquerra en tenim 2b àtoms d'hidrogen (2 en cada H2O), mentre que a la dreta hi ha 3c+d àtoms d'hidrogen (3 en cada H3PO4 i 1 a cada molècula d’HCl). Atès que els costats esquerre i dret han de contenir el mateix nombre d’àtoms d’hidrogen, 2b ha de ser igual a 3c+d.
- Feu això per a tots els elements:
- P: a=c
- Cl: 5a=d
- H: 2b=3c+d
- 4 Resol el sistema d’equacions per trobar els valors numèrics dels coeficients. El sistema té diverses solucions, ja que hi ha més variables que equacions. Cal trobar aquesta solució perquè tots els coeficients tinguin la forma dels nombres enters més petits possibles.
- Per resoldre ràpidament un sistema d’equacions, assigneu un valor numèric a una de les variables. Suposem que a = 1. Resolvem el sistema i trobem els valors de les variables restants:
- Per P a = c, doncs c = 1
- Per a Cl 5a = d, per tant, d = 5
- Com que per H 2b = 3c + d, trobem el valor b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Per tant, tenim els següents coeficients:
- a = 1
- b = 4
- c = 1
- d = 5
Consells
- Si teniu dificultats, es pot utilitzar una calculadora en línia per equilibrar equacions químiques. Tingueu en compte, però, que no es permet utilitzar aquesta calculadora durant l’examen, de manera que no confieu únicament en ella.
- Recordeu que, de vegades, l’equació es pot simplificar. Si tots els coeficients són fins i tot divisibles per un enter, simplifiqueu l'equació.
Advertiments
- Per desfer-se dels coeficients fraccionaris, multipliqueu l’equació sencera (els seus costats esquerre i dret) pel denominador de la fracció.
- No utilitzeu mai fraccions com a coeficients de l’equació química: no hi ha mitjanes molècules ni àtoms en les reaccions químiques.
- En el procés d’equilibri, podeu utilitzar fraccions per comoditat, però l’equació no està equilibrada sempre que hi hagi coeficients fraccionaris.