Autora:
Eric Farmer
Data De La Creació:
10 Març 2021
Data D’Actualització:
1 Juliol 2024
Content
- Passos
- Mètode 1 de 2: Determinació del nombre de neutrons en àtoms (no isòtops)
- Mètode 2 de 2: Determinació del nombre de neutrons en els isòtops
- Consells
En els àtoms del mateix element, el nombre de protons és constant, mentre que el nombre de neutrons pot variar.Sabent quants neutrons conté un àtom en concret, podeu determinar si és un àtom regular o un isòtop que tindrà menys o més neutrons. Determinar el nombre de neutrons en un àtom és bastant senzill. Tot el que heu de fer per calcular el nombre de neutrons d’un àtom o isòtop és seguir les nostres instruccions i mantenir la taula periòdica a mà.
Passos
Mètode 1 de 2: Determinació del nombre de neutrons en àtoms (no isòtops)
 1 Cerqueu l’element de la taula periòdica. Com a exemple, considerarem osmi (Os), que es troba al sisè període (sisena fila des de la part superior).
1 Cerqueu l’element de la taula periòdica. Com a exemple, considerarem osmi (Os), que es troba al sisè període (sisena fila des de la part superior).  2 Trobeu el nombre atòmic de l’element. Aquest és, per regla general, el nombre més notable de la cel·la d’un element i se situa normalment per sobre del seu símbol (a la versió de la taula periòdica que utilitzem al nostre exemple, no hi ha altres números). El nombre atòmic és el nombre de protons d’un àtom d’aquest element. Per a l’osmi, aquest nombre és 76, és a dir, hi ha 76 protons en un àtom d’osmi.
2 Trobeu el nombre atòmic de l’element. Aquest és, per regla general, el nombre més notable de la cel·la d’un element i se situa normalment per sobre del seu símbol (a la versió de la taula periòdica que utilitzem al nostre exemple, no hi ha altres números). El nombre atòmic és el nombre de protons d’un àtom d’aquest element. Per a l’osmi, aquest nombre és 76, és a dir, hi ha 76 protons en un àtom d’osmi. - El nombre de protons no canvia, i això és el que fa que un element sigui un element.
 3 Troba la massa atòmica d’un element. Aquest nombre se sol trobar a sota del símbol de l’element. Tingueu en compte que a la versió de la taula periòdica del nostre exemple, la massa atòmica no es dóna (no sempre és així; en moltes versions de la taula periòdica s’indica la massa atòmica). La massa atòmica d’osmi és de 190,23.
3 Troba la massa atòmica d’un element. Aquest nombre se sol trobar a sota del símbol de l’element. Tingueu en compte que a la versió de la taula periòdica del nostre exemple, la massa atòmica no es dóna (no sempre és així; en moltes versions de la taula periòdica s’indica la massa atòmica). La massa atòmica d’osmi és de 190,23.  4 Arrodoneix la massa atòmica al nombre enter més proper. En el nostre exemple, 190,23 s’arrodoneix a 190.
4 Arrodoneix la massa atòmica al nombre enter més proper. En el nostre exemple, 190,23 s’arrodoneix a 190. - La massa atòmica és el nombre mitjà d’isòtops d’un element concret, normalment no s’expressa com un nombre enter.
 5 Restar el nombre atòmic de la massa atòmica. Com que els protons i els neutrons representen la porció absoluta de la massa atòmica, restant el nombre de protons (és a dir, el nombre atòmic, que és igual al nombre de protons) de la massa atòmica, es dóna el nombre de neutrons de l’àtom. Els números posteriors al punt decimal fan referència a la massa molt petita d’electrons d’un àtom. En el nostre exemple: 190 (pes atòmic) - 76 (nombre de protons) = 114 (nombre de neutrons).
5 Restar el nombre atòmic de la massa atòmica. Com que els protons i els neutrons representen la porció absoluta de la massa atòmica, restant el nombre de protons (és a dir, el nombre atòmic, que és igual al nombre de protons) de la massa atòmica, es dóna el nombre de neutrons de l’àtom. Els números posteriors al punt decimal fan referència a la massa molt petita d’electrons d’un àtom. En el nostre exemple: 190 (pes atòmic) - 76 (nombre de protons) = 114 (nombre de neutrons).  6 Recordeu la fórmula. Per trobar el nombre de neutrons en el futur, simplement utilitzeu aquesta fórmula:
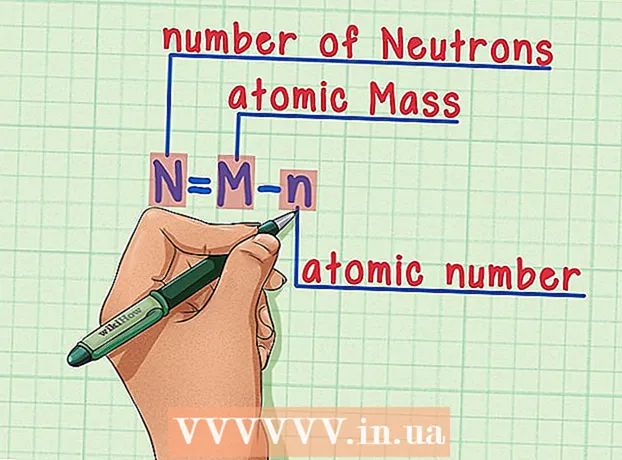
6 Recordeu la fórmula. Per trobar el nombre de neutrons en el futur, simplement utilitzeu aquesta fórmula: - N = M - n
- N = nombre de neutrons
- M = massa atòmica
- n = nombre atòmic
- N = M - n
Mètode 2 de 2: Determinació del nombre de neutrons en els isòtops
 1 Cerqueu l’element de la taula periòdica. Com a exemple, considerarem l’isòtop del carboni 14C. Com que el carboni no isotòpic 14C és només carboni C, trobeu carboni a la taula periòdica (segon període o segona fila des de la part superior).
1 Cerqueu l’element de la taula periòdica. Com a exemple, considerarem l’isòtop del carboni 14C. Com que el carboni no isotòpic 14C és només carboni C, trobeu carboni a la taula periòdica (segon període o segona fila des de la part superior).  2 Trobeu el nombre atòmic de l’element. Aquest és, per regla general, el nombre més notable de la cel·la d’un element i se situa normalment per sobre del seu símbol (a la versió de la taula periòdica que utilitzem al nostre exemple, no hi ha altres números). El nombre atòmic és el nombre de protons d’un àtom d’aquest element. El carboni és el número 6, el que significa que un carboni té sis protons.
2 Trobeu el nombre atòmic de l’element. Aquest és, per regla general, el nombre més notable de la cel·la d’un element i se situa normalment per sobre del seu símbol (a la versió de la taula periòdica que utilitzem al nostre exemple, no hi ha altres números). El nombre atòmic és el nombre de protons d’un àtom d’aquest element. El carboni és el número 6, el que significa que un carboni té sis protons.  3 Troba la massa atòmica. En el cas dels isòtops, això és molt fàcil de fer, ja que s’anomenen segons la seva massa atòmica. En el nostre cas, el carboni 14C té una massa atòmica de 14. Ara coneixem la massa atòmica de l’isòtop; el procés de càlcul posterior és el mateix que per determinar el nombre de neutrons en àtoms (no isòtops).
3 Troba la massa atòmica. En el cas dels isòtops, això és molt fàcil de fer, ja que s’anomenen segons la seva massa atòmica. En el nostre cas, el carboni 14C té una massa atòmica de 14. Ara coneixem la massa atòmica de l’isòtop; el procés de càlcul posterior és el mateix que per determinar el nombre de neutrons en àtoms (no isòtops).  4 Restar el nombre atòmic de la massa atòmica. Com que els protons i els neutrons representen la porció absoluta de la massa atòmica, restant el nombre de protons (és a dir, el nombre atòmic, que és igual al nombre de protons) de la massa atòmica, es dóna el nombre de neutrons de l’àtom. En el nostre exemple: 14 (massa atòmica) - 6 (nombre de protons) = 8 (nombre de neutrons).
4 Restar el nombre atòmic de la massa atòmica. Com que els protons i els neutrons representen la porció absoluta de la massa atòmica, restant el nombre de protons (és a dir, el nombre atòmic, que és igual al nombre de protons) de la massa atòmica, es dóna el nombre de neutrons de l’àtom. En el nostre exemple: 14 (massa atòmica) - 6 (nombre de protons) = 8 (nombre de neutrons).  5 Recordeu la fórmula. Per trobar el nombre de neutrons en el futur, simplement utilitzeu aquesta fórmula:
5 Recordeu la fórmula. Per trobar el nombre de neutrons en el futur, simplement utilitzeu aquesta fórmula: - N = M - n
- N = nombre de neutrons
- M = massa atòmica
- n = nombre atòmic
- N = M - n
Consells
- Els protons i els neutrons constitueixen gairebé la massa absoluta dels elements, mentre que els electrons i altres partícules formen una massa extremadament insignificant (aquesta massa tendeix a zero).Com que un protó té aproximadament la mateixa massa que un neutró i el nombre atòmic és el nombre de protons, podeu restar el nombre de protons de la massa total.
- Osmium - un metall en estat sòlid a temperatura ambient, va rebre el seu nom de la paraula grega "osme" - olor.
- Si no esteu segur del que significa un número de la taula periòdica, recordeu: la taula sol construir-se al voltant d’un nombre atòmic (és a dir, el nombre de protons), que comença per 1 (hidrogen) i creix una unitat d’esquerra a dreta. , acabant amb 118 (Oganesson). Això es deu al fet que el nombre de protons d’un àtom determina l’element en si, i aquest nombre és la forma més senzilla d’organitzar els elements (per exemple, un àtom amb 2 protons sempre és heli, igual que un àtom amb 79 protons sempre és or ).