Autora:
Florence Bailey
Data De La Creació:
21 Març 2021
Data D’Actualització:
1 Juliol 2024
Content
- Passos
- Mètode 1 de 2: Distribució d'electrons mitjançant el sistema periòdic de D. I. Mendeleev
- Mètode 2 de 2: Utilització de la taula periòdica ADOMAH
- Consells
Configuració electrònica un àtom és una representació numèrica dels seus orbitals electrònics. Els orbitals electrònics són regions de diverses formes situades al voltant d’un nucli atòmic en què un electró és matemàticament probable. La configuració electrònica ajuda a dir ràpidament i fàcilment al lector quants orbitals d’electrons té un àtom, així com a determinar el nombre d’electrons de cada orbital. Després de llegir aquest article, haureu dominat el mètode de generació de configuracions electròniques.
Passos
Mètode 1 de 2: Distribució d'electrons mitjançant el sistema periòdic de D. I. Mendeleev
 1 Cerqueu el nombre atòmic del vostre àtom. Cada àtom té un nombre específic d’electrons associat. Cerqueu el símbol del vostre àtom a la taula periòdica. Un nombre atòmic és un nombre enter positiu que comença en 1 (per a l'hidrogen) i augmenta en un per cada àtom posterior. Un nombre atòmic és el nombre de protons d’un àtom i, per tant, també és el nombre d’electrons d’un àtom amb càrrega zero.
1 Cerqueu el nombre atòmic del vostre àtom. Cada àtom té un nombre específic d’electrons associat. Cerqueu el símbol del vostre àtom a la taula periòdica. Un nombre atòmic és un nombre enter positiu que comença en 1 (per a l'hidrogen) i augmenta en un per cada àtom posterior. Un nombre atòmic és el nombre de protons d’un àtom i, per tant, també és el nombre d’electrons d’un àtom amb càrrega zero. - 2 Determineu la càrrega d’un àtom. Els àtoms neutres tindran el mateix nombre d’electrons que es mostra a la taula periòdica. No obstant això, els àtoms carregats tindran més o menys electrons, depenent de la quantitat de la seva càrrega. Si esteu treballant amb un àtom carregat, sumeu o resteu electrons de la següent manera: afegiu un electró per cada càrrega negativa i resteu-ne un per cada positiu.
- Per exemple, un àtom de sodi amb una càrrega de -1 tindrà un electró addicional a més al seu nombre atòmic base 11. En altres paraules, l'àtom total tindrà 12 electrons.
- Si parlem d’un àtom de sodi amb una càrrega de +1, s’ha de restar un electró del número atòmic base 11. Així, l’àtom tindrà 10 electrons.
- 3 Recordeu la llista bàsica d’orbitals. A mesura que augmenta el nombre d’electrons, omplen els diversos subnivells de la capa d’electrons de l’àtom segons una seqüència determinada. Cada subnivell de la capa d’electrons, quan s’omple, conté un nombre parell d’electrons. Hi ha disponibles els subnivells següents:
- s-subnivell (qualsevol número de la configuració electrònica que aparegui abans de la lletra "s") conté un únic orbital i, segons Principi de Pauli, un orbital pot contenir un màxim de 2 electrons, per tant, hi pot haver 2 electrons a cada subnivell s de la capa de l'electró.
- p-subnivell conté 3 orbitals i, per tant, pot contenir un màxim de 6 electrons.
- dnivell conté 5 orbitals, de manera que pot tenir fins a 10 electrons.
- f-subnivell conté 7 orbitals, de manera que pot tenir fins a 14 electrons.
- subnivells g-, h-, i- i k són teòriques. Es desconeixen els àtoms que contenen electrons en aquests orbitals. El subnivell g conté 9 orbitals, de manera que teòricament podria tenir 18 electrons. El subnivell h pot tenir 11 orbitals i un màxim de 22 electrons; als orbitals i-subnivell -13 i un màxim de 26 electrons; al subnivell k: 15 orbitals i un màxim de 30 electrons.
- Memoritzeu l'ordre dels orbitals mitjançant el truc mnemotècnic:
Sober Pàgfisics Don’t Find Giraffes Hidentificació Jon Kpruïja (els físics sobris no troben girafes amagades a les cuines).
- 4 Comprendre el registre de configuració electrònica. Les configuracions electròniques es registren per reflectir clarament el nombre d’electrons de cada orbital. Els orbitals s’escriuen seqüencialment, sent el nombre d’àtoms de cada orbital superíndex a la dreta del nom orbital. La configuració electrònica completada té la forma d’una seqüència de designacions de subnivell i superíndexs.
- Per exemple, la configuració electrònica més senzilla: 1s 2s 2p. Aquesta configuració mostra que hi ha dos electrons al subnivell 1s, dos electrons al subnivell 2s i sis electrons al subnivell 2p. 2 + 2 + 6 = 10 electrons en total. Aquesta és la configuració electrònica d’un àtom de neó neutre (el nombre atòmic de neó és 10).
- 5 Recordeu l’ordre dels orbitals. Tingueu en compte que els orbitals dels electrons estan numerats en ordre ascendent del nombre de la capa de l’electró, però en ordre ascendent d’energia. Per exemple, un orbital 4s ple és menys energètic (o menys mòbil) que un 3d parcialment ple o ple, de manera que l’orbital 4s s’enregistra primer. Un cop conegut l’ordre dels orbitals, podeu emplenar-los fàcilment segons el nombre d’electrons de l’àtom. L’ordre d’omplir els orbitals és el següent: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- La configuració electrònica d’un àtom en què s’omplen tots els orbitals tindrà el següent formulari: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Tingueu en compte que l’entrada anterior, quan s’omplen tots els orbitals, és la configuració electrònica de l’element Uuo (ununoctium) 118, l’àtom més numerat de la taula periòdica. Per tant, aquesta configuració electrònica conté tots els subnivells electrònics coneguts actualment d’un àtom amb càrrega neutra.
- 6 Empleneu els orbitals segons el nombre d’electrons del vostre àtom. Per exemple, si volem escriure la configuració electrònica d’un àtom de calci neutre, hem de començar a buscar el seu nombre atòmic a la taula periòdica. El seu nombre atòmic és 20, de manera que escriurem la configuració d’un àtom amb 20 electrons segons l’ordre anterior.
- Empleneu els orbitals en l’ordre anterior fins arribar al vintè electró. El primer orbital 1s contindrà dos electrons, els orbitals 2s també tindran dos, 2p - sis, 3s - dos, 3p - 6 i 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20). en altres paraules, la configuració electrònica del calci és: 1s 2s 2p 3s 3p 4s.
- Tingueu en compte que els orbitals estan en ordre ascendent d’energia. Per exemple, quan estigueu a punt per passar al quart nivell d’energia, anoteu primer l’orbital 4s i llavors 3d. Després del quart nivell d’energia, aneu al cinquè, on es repeteix el mateix ordre. Això passa només després del tercer nivell d'energia.
- 7 Utilitzeu la taula periòdica com a pista visual. Probablement ja heu notat que la forma de la taula periòdica correspon a l'ordre dels subnivells electrònics de les configuracions electròniques. Per exemple, els àtoms de la segona columna de l'esquerra acaben sempre en "s", mentre que els àtoms de la vora dreta de la fina secció mitjana sempre acaben en "d", etc. Utilitzeu la taula periòdica com a guia visual de configuracions d’escriptura, ja que l’ordre en què afegiu als orbitals correspon a la vostra posició a la taula. Mirar abaix:
- En particular, les dues columnes més a l’esquerra contenen àtoms les configuracions electròniques dels quals acaben en orbitals s, el bloc dret de la taula conté àtoms les configuracions dels quals acaben en orbitals p i, a la part inferior, els àtoms acaben en orbitals f.
- Per exemple, quan escriviu la configuració electrònica del clor, penseu així: "Aquest àtom es troba a la tercera fila (o" punt ") de la taula periòdica. També es troba al cinquè grup del bloc orbital p del sistema periòdic. Per tant, la seva configuració electrònica acabarà en .3p
- Tingueu en compte que els elements de la regió dels orbitals d i f de la taula es caracteritzen per nivells d’energia que no es corresponen amb el període en què es troben. Per exemple, la primera fila del bloc d’elements amb orbitals d correspon a orbitals 3d, tot i que es troba al quart període, i la primera fila d’elements amb orbitals f correspon a l’orbital 4f, tot i que és al 6è període.
- 8 Apreneu la abreviatura per escriure configuracions electròniques llargues. Es diuen els àtoms de la vora dreta de la taula periòdica gasos nobles. Aquests elements són químicament molt estables. Per escurçar el procés d’escriptura de llargues configuracions electròniques, simplement escriviu entre claudàtors el símbol químic del gas noble més proper amb menys electrons que el vostre àtom i, a continuació, continueu escrivint la configuració electrònica dels nivells orbitals posteriors. Mirar abaix:
- Per entendre aquest concepte, és útil escriure un exemple de configuració. Escrivim la configuració del zinc (número atòmic 30) mitjançant l’abreviatura de gas noble. La configuració completa de zinc té aquest aspecte: 1s 2s 2p 3s 3p 4s 3d. Tot i això, veiem que 1s 2s 2p 3s 3p és la configuració electrònica de l’argó, un gas noble. Simplement substituïu la part de configuració electrònica de zinc pel símbol químic argó entre claudàtors ([Ar].)
- Per tant, la configuració electrònica del zinc, escrita en forma abreujada, és: [Ar] 4s 3d.
- Tingueu en compte que si escriviu la configuració electrònica d’un gas noble, per exemple, l’argó, no podeu escriure [Ar]. S’ha d’utilitzar la reducció del gas noble que afronta aquest element; per a l’argó serà neó ([Ne]).
Mètode 2 de 2: Utilització de la taula periòdica ADOMAH
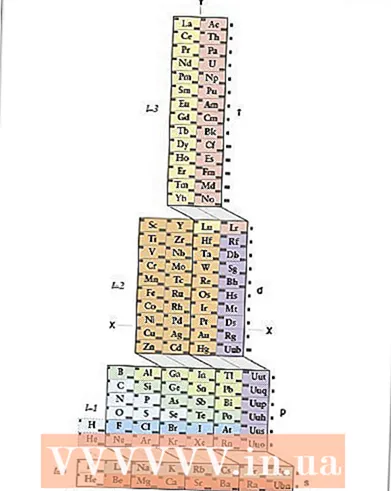
 1 Conegueu la taula periòdica ADOMAH. Aquest mètode d’enregistrament de la configuració electrònica no requereix memorització, però requereix una taula periòdica revisada, ja que a la taula periòdica tradicional, a partir del quart període, el número de període no es correspon amb la capa electrònica. Trobeu la taula periòdica ADOMAH: un tipus especial de taula periòdica desenvolupada pel científic Valery Zimmerman. És fàcil trobar-lo amb una breu cerca a Internet.
1 Conegueu la taula periòdica ADOMAH. Aquest mètode d’enregistrament de la configuració electrònica no requereix memorització, però requereix una taula periòdica revisada, ja que a la taula periòdica tradicional, a partir del quart període, el número de període no es correspon amb la capa electrònica. Trobeu la taula periòdica ADOMAH: un tipus especial de taula periòdica desenvolupada pel científic Valery Zimmerman. És fàcil trobar-lo amb una breu cerca a Internet. - A la taula periòdica d’ADOMAH, les files horitzontals representen grups d’elements com halògens, gasos nobles, metalls alcalins, metalls alcalins terrosos, etc. Les columnes verticals corresponen a nivells electrònics i les anomenades "cascades" (línies diagonals que connecten els blocs s, p, d i f) corresponen a períodes.
- L'heli es trasllada a l'hidrogen, ja que tots dos elements tenen un orbital de 1 s. Els blocs de períodes (s, p, d i f) es mostren a la part dreta i els números de nivell es mostren a la part inferior. Els elements es mostren a les caselles numerades de l’1 al 120. Aquests nombres són nombres atòmics comuns que representen el nombre total d’electrons d’un àtom neutre.
- 2 Cerqueu el vostre àtom a la taula ADOMAH. Per registrar la configuració electrònica d’un element, busqueu el seu símbol a la taula periòdica ADOMAH i ratlleu tots els elements amb un nombre atòmic superior. Per exemple, si heu d’escriure la configuració electrònica de l’erbi (68), ratlleu tots els elements del 69 al 120.
- Tingueu en compte els números de l'1 al 8 a la part inferior de la taula. Es tracta de números de nivell electrònic o números de columna. Ignoreu les columnes que només contenen elements ratllats.Per a l'erbi, queden les columnes numerades 1, 2, 3, 4, 5 i 6.
- 3 Compteu els subnivells orbitals al vostre element. Si mireu els símbols de blocs que es mostren a la dreta de la taula (s, p, d i f) i els números de columna que es mostren a la part inferior, ignoreu les línies diagonals entre els blocs i trenqueu les columnes en blocs de columnes en ordre de baix a dalt. De nou, ignoreu les caselles amb tots els elements ratllats. Escriviu els blocs de columna, començant pel número de columna seguit del símbol de bloc, així: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (per a l'erbi).
- Nota: La configuració electrònica anterior Er s’escriu en ordre ascendent del número de subnivell electrònic. També es pot escriure en l’ordre d’omplir els orbitals. Per fer-ho, seguiu les cascades de baix a dalt, no les columnes quan escriviu els blocs de columnes: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Compteu els electrons de cada subnivell electrònic. Compteu els elements de cada columna de blocs que no s’han ratllat, adjuntant un electró de cada element i escriviu el seu número al costat del símbol de bloc de cada columna de blocs de la següent manera: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6 s ... En el nostre exemple, aquesta és la configuració electrònica de l'erbi.
- 5 Penseu en configuracions electròniques incorrectes. Hi ha divuit excepcions típiques relacionades amb les configuracions electròniques d’àtoms en estat d’energia més baixa, també anomenat estat d’energia terrestre. No obeeixen la regla general només a les dues o tres darreres posicions ocupades pels electrons. En aquest cas, la configuració electrònica real suposa que els electrons es troben en un estat amb una energia inferior en comparació amb la configuració estàndard de l'àtom. Els àtoms d’excepció inclouen:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Núm (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Déu (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); AC (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) i Cm (..., 5f7, 6d1, 7s2).
Consells
- Per trobar el nombre atòmic d'un àtom quan s'escriu en configuració electrònica, només cal que sumeu tots els números que segueixen les lletres (s, p, d i f). Això només funciona per a àtoms neutres; si teniu un ió, res no funcionarà: heu de sumar o restar el nombre d’electrons extra o perduts.
- El número següent a la lletra és un superíndex, no cometeu cap error al xec.
- No hi ha un subnivell "estabilitat d'un mig omplert". Això és una simplificació. Qualsevol estabilitat relacionada amb els subnivells "mig emplenats" es deu al fet que cada orbital està ocupat per un electró, de manera que es minimitza la repulsió entre els electrons.
- Cada àtom tendeix a un estat estable i les configuracions més estables han omplert els subnivells s i p (s2 i p6). Els gasos nobles tenen aquesta configuració, per tant poques vegades entren en reaccions i es localitzen a la dreta a la taula periòdica. Per tant, si la configuració acaba a 3p, necessita dos electrons per assolir un estat estable (per perdre-ne sis, inclosos els electrons del subnivell s, es necessita més energia, de manera que és més fàcil perdre-ne quatre). I si la configuració acaba en 4d, ha de perdre tres electrons per arribar a un estat estable. A més, els subnivells mig omplerts (s1, p3, d5 ..) són més estables que, per exemple, p4 o p2; tanmateix, s2 i p6 seran encara més robustos.
- Quan es tracta d’un ió, això significa que el nombre de protons no és igual al nombre d’electrons. En aquest cas, la càrrega d'un àtom es mostrarà a la part superior dreta (per regla general) del símbol químic. Per tant, un àtom d’antimoni amb una càrrega de +2 té la configuració electrònica 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Tingueu en compte que el 5p ha canviat a 5p. Aneu amb compte quan la configuració d'un àtom neutre acabi en subnivells diferents de s i p. Quan agafeu electrons, només els podreu agafar dels orbitals de valència (orbitals s i p).Per tant, si la configuració acaba en 4s 3d i l'àtom guanya una càrrega de +2, la configuració acabarà en 4s 3d. Tingueu en compte que 3d no canvia, en lloc de perdre electrons s-orbitals.
- Hi ha condicions en què l'electró es veu obligat a "anar a un nivell d'energia superior". Quan a un subnivell li falta un electró per la meitat o un farciment complet, agafeu un electró del subnivell s o p més proper i moveu-lo al subnivell que necessita un electró.
- Hi ha dues opcions per enregistrar una configuració electrònica. Es poden escriure en ordre ascendent de nombres de nivells d'energia o en l'ordre de farciment dels orbitals d'electrons, com es va mostrar més amunt per a l'erbi.
- També podeu escriure la configuració electrònica d’un element escrivint només la configuració de valència, que és l’últim subnivell s i p. Per tant, la configuració de valència de l’antimoni tindrà la forma 5s 5p.
- Jonàs no és el mateix. Amb ells és molt més difícil. Saltar dos nivells i seguir el mateix patró en funció d'on va començar i el nombre d'electrons és gran.