Autora:
Lewis Jackson
Data De La Creació:
12 Ser Possible 2021
Data D’Actualització:
1 Juliol 2024
Content
Determinar el nombre de neutrons en un àtom és bastant senzill, ni tan sols cal que feu cap experiment. Per calcular el nombre de neutrons d’un àtom o isòtop normal, només cal tenir a punt una taula periòdica i seguir les instruccions.
Passos
Mètode 1 de 2: trobeu el nombre de neutrons en un àtom normal
Determineu la posició de l’element sobre la taula periòdica. Com a exemple, trobarem l'element osmium (Os) a la sisena fila de la part superior.

Trobeu el nombre atòmic de l’element. Aquest és el nombre més visible que passa per cada element i que està per sobre del símbol primer (a la pissarra que estem utilitzant no hi ha altres números). El nombre atòmic és el nombre de protons d’un sol àtom d’aquest element. Os és el número 76, el que significa que hi ha 76 protons en un àtom d’osmi.- El nombre de protons no canvia mai en un element; és essencialment la característica que defineix un element.

Trobeu el pes atòmic de l’element. Aquest nombre se sol trobar a sota del símbol principal. Tingueu en compte que la taula periòdica d’aquest exemple només té nombre atòmic i no té pes atòmic. No totes les taules periòdiques. L’osmi té un pes atòmic de 190,23.
Arrodoneix el pes atòmic al nombre enter més proper per obtenir la massa atòmica. Per exemple, 190,23 s’arrodoniria a 190, de manera que la massa atòmica d’osmi és 190.- El pes atòmic és la mitjana d’isòtops d’un mateix element químic, per això no sol ser un nombre enter.
Restar el nombre atòmic de la massa atòmica. Com que la major part de la massa atòmica és la massa de protons i neutrons, restant el nombre de protons de la massa atòmica (és a dir, el nombre atòmic) obtindreu comptar obtenir el nombre de neutrons de l’àtom. El nombre després del punt decimal representa la massa molt petita d’electrons de l’àtom. En aquest exemple, tenim: 190 (àtom de massa) - 76 (nombre de protons) = 114 (nombre de neutrons).
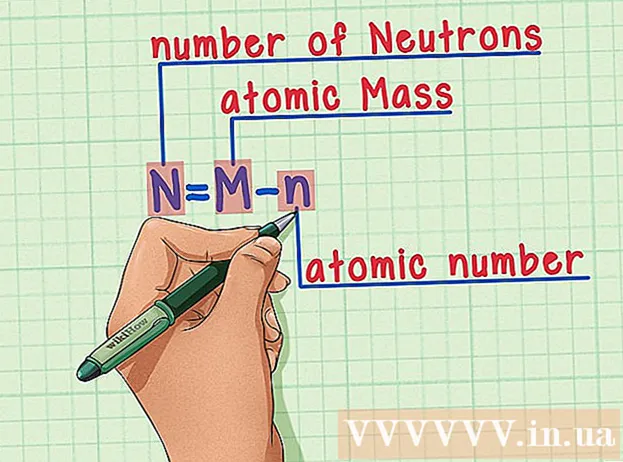
Memoritza la recepta. Per trobar el nombre de neutrons, simplement apliquem la fórmula següent:
- N = M - n
- N = nombre de neutrons
- M = massa atòmica
- n = nombre atòmic
- N = M - n
Mètode 2 de 2: trobeu el nombre de neutrons de l’isòtop
Determineu la posició de l’element sobre la taula periòdica. Prenguem com a exemple l’element isòtop carboni-14. Com que la forma isòtop del carboni 14 és simplement carboni (C), busqueu carboni a la taula periòdica (segona fila des de la part superior).
Trobeu el nombre atòmic de l’element. Aquest és el nombre més visible que passa per cada element i que està per sobre del símbol primer (a la pissarra que estem utilitzant no hi ha altres números). El nombre atòmic és el nombre de protons d’un sol àtom d’aquest element. C és el número 6, el que significa que hi ha 6 protons en un àtom de carboni.
Troba la massa atòmica. Això és extremadament fàcil amb els isòtops perquè porten el nom de la massa atòmica. Per exemple, el carboni 14 tindrà una massa atòmica de 14. Un cop trobada la massa atòmica de l’isòtop, els passos restants per trobar el nombre de neutrons seran els mateixos que els d’un àtom normal.
Restar el nombre atòmic de la massa atòmica. Com que la major part de la massa atòmica és la massa de protons i neutrons, restant el nombre de protons de la massa atòmica (és a dir, el nombre atòmic) obtindreu comptar obtenir el nombre de neutrons de l’àtom. El nombre després del punt decimal representa la massa molt petita d’electrons de l’àtom. En aquest exemple, tenim: 14 (àtom de massa) - 6 (nombre de protons) = 8 (nombre de neutrons).
Memoritza la recepta. Per trobar el nombre de neutrons, apliquem la fórmula següent:
- N = M - n
- N = nombre de neutrons
- M = massa atòmica
- n = nombre atòmic
- N = M - n
Consells
- La massa d’un element és en gran mesura la massa de protons i neutrons, mentre que les masses d’electrons i altres elements són insignificants (properes a zero). Com que la massa del protó és aproximadament igual a la massa del neutró i el nombre atòmic representa el nombre de protons, simplement restem el nombre de protons de la massa total.
- Si no recordeu el significat dels nombres de la taula periòdica, recordeu que la taula periòdica normalment es basa en nombres atòmics (és a dir, el nombre de protons), començant per 1 (hidrogen) i incrementant una paraula d’esquerra a dreta, acabant amb 118 (ununoctium). Atès que el nombre de protons és una característica identificativa de cada àtom, és la propietat més simple sobre la qual es disposen els elements. (Per exemple, un àtom amb 2 protons sempre és heli, de la mateixa manera que un àtom amb 79 protons sempre és or.)
Fonts i cites
- Taula periòdica interactiva