Autora:
Charles Brown
Data De La Creació:
2 Febrer 2021
Data D’Actualització:
28 Juny 2024

Content
- Per trepitjar
- Mètode 1 de 3: enllaços iònics bàsics
- Mètode 2 de 3: metalls de transició
- Mètode 3 de 3: enllaços amb ions poliatòmics
- Consells
Els enllaços iònics consisteixen en cations (ions positius) i anions (ions negatius). Els enllaços iònics consisteixen generalment en un metall i un o més no metalls. Per anomenar un enllaç iònic, només cal trobar el nom del catió i l’anió presents al compost. Primer heu d’escriure el nom del metall, seguit del nom del no metall amb el seu corresponent nou final. Si voleu saber com anomenar els enllaços iònics en diverses situacions, seguiu aquests passos.
Per trepitjar
Mètode 1 de 3: enllaços iònics bàsics
 Anoteu la fórmula de l’enllaç iònic. Diguem el vincle iònic en què esteu treballant NaCl és.
Anoteu la fórmula de l’enllaç iònic. Diguem el vincle iònic en què esteu treballant NaCl és.  Escriviu el nom del metall o catió. Aquest és l’ió carregat positivament a l’enllaç i sempre s’escriu primer en una fórmula d’enllaç iònic. Després és sodi. Així que escriu Sodi encès.
Escriviu el nom del metall o catió. Aquest és l’ió carregat positivament a l’enllaç i sempre s’escriu primer en una fórmula d’enllaç iònic. Després és sodi. Així que escriu Sodi encès.  Escriviu el nom del no-metall o anió amb la terminació "-ide".Cl és el clor (clor). Per afegir la terminació "ide", només cal substituir l'última síl·laba "-ine" per "-ide". Es converteix en clor clorur.
Escriviu el nom del no-metall o anió amb la terminació "-ide".Cl és el clor (clor). Per afegir la terminació "ide", només cal substituir l'última síl·laba "-ine" per "-ide". Es converteix en clor clorur.  Combina els noms. El NaCl es pot escriure com clorur de sodi.
Combina els noms. El NaCl es pot escriure com clorur de sodi.  Practicar el nom dels enllaços iònics simples. Un cop hàgiu aconseguit aquesta fórmula, proveu de nomenar alguns enllaços iònics més simples. Fins i tot memoritzar uns quants us pot ajudar a entendre millor com anomenar els enllaços iònics. Aquí en teniu algunes més:
Practicar el nom dels enllaços iònics simples. Un cop hàgiu aconseguit aquesta fórmula, proveu de nomenar alguns enllaços iònics més simples. Fins i tot memoritzar uns quants us pot ajudar a entendre millor com anomenar els enllaços iònics. Aquí en teniu algunes més: - Li2S = Sulfur de liti

- Ag2S = Sulfur de plata

- MgCl2 = Clorur de magnesi

- Li2S = Sulfur de liti
Mètode 2 de 3: metalls de transició
 Anoteu la fórmula de l’enllaç iònic. Els metalls de transició es poden trobar al centre de la taula periòdica. Van rebre el seu nom perquè els seus nombres d’oxidació o les seves càrregues canvien constantment. Suposem que esteu treballant amb aquest vincle: Fe2O3.
Anoteu la fórmula de l’enllaç iònic. Els metalls de transició es poden trobar al centre de la taula periòdica. Van rebre el seu nom perquè els seus nombres d’oxidació o les seves càrregues canvien constantment. Suposem que esteu treballant amb aquest vincle: Fe2O3.  Anoteu la càrrega del metall. Saps que el metall tindrà una càrrega positiva perquè puguis obtenir el 3 de O3 ratlla i escriu això Fe té un càrrec de +3. (Per diversió, podeu fer el contrari i escriure-ho O té un càrrec de -2.) De vegades s’indicarà el càrrec.
Anoteu la càrrega del metall. Saps que el metall tindrà una càrrega positiva perquè puguis obtenir el 3 de O3 ratlla i escriu això Fe té un càrrec de +3. (Per diversió, podeu fer el contrari i escriure-ho O té un càrrec de -2.) De vegades s’indicarà el càrrec.  Anoteu el nom del metall. Ja que ho saps Fe planxa i que té una càrrega de +3, ho podeu fer Ferro (III) esmentar. Recordeu que heu d’utilitzar només números romans quan escriviu el nom i no quan escriviu la fórmula.
Anoteu el nom del metall. Ja que ho saps Fe planxa i que té una càrrega de +3, ho podeu fer Ferro (III) esmentar. Recordeu que heu d’utilitzar només números romans quan escriviu el nom i no quan escriviu la fórmula.  Escriviu el nom del no-metall. Ja que ho saps O significa oxigen, podeu afegir la terminació "-ide" i anomenar-la "òxid".
Escriviu el nom del no-metall. Ja que ho saps O significa oxigen, podeu afegir la terminació "-ide" i anomenar-la "òxid".  Combineu el nom i el segon nom. Ara ja ho tens. Fe2O3 = Idexid de ferro (III).
Combineu el nom i el segon nom. Ara ja ho tens. Fe2O3 = Idexid de ferro (III).  Utilitzeu el mètode de denominació anterior. En el mètode de denominació anterior, que també s'utilitza, utilitzeu els noms "ferro" i "ferric" per als metalls, en lloc dels números romans. Si l’ió metàl·lic té un estat d’oxidació inferior (una càrrega numèrica inferior, ignorant el "+" o el "-"), utilitzeu "ferrós". Si té una càrrega superior, utilitzeu "ferri". El Fe té l’estat inferior (el Fe té l’estat superior), de manera que esdevé ferrosa. El nom de FeO també es pot escriure com ferroxid.
Utilitzeu el mètode de denominació anterior. En el mètode de denominació anterior, que també s'utilitza, utilitzeu els noms "ferro" i "ferric" per als metalls, en lloc dels números romans. Si l’ió metàl·lic té un estat d’oxidació inferior (una càrrega numèrica inferior, ignorant el "+" o el "-"), utilitzeu "ferrós". Si té una càrrega superior, utilitzeu "ferri". El Fe té l’estat inferior (el Fe té l’estat superior), de manera que esdevé ferrosa. El nom de FeO també es pot escriure com ferroxid. 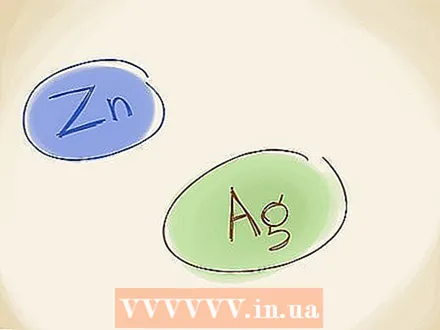 Recordeu les excepcions. Hi ha dos metalls de transició que no tenen una càrrega fixa. Es tracta de zinc (Zn) i plata (Ag). Això vol dir que no cal que utilitzeu els números romans ni el mètode de denominació anterior a l'hora de descriure aquests elements.
Recordeu les excepcions. Hi ha dos metalls de transició que no tenen una càrrega fixa. Es tracta de zinc (Zn) i plata (Ag). Això vol dir que no cal que utilitzeu els números romans ni el mètode de denominació anterior a l'hora de descriure aquests elements.
Mètode 3 de 3: enllaços amb ions poliatòmics
 Anoteu la fórmula de l’ió poliatòmic. Aquest enllaç estarà format per més de dos ions. Suposem que esteu treballant en el següent vincle: FeNH4(TAN4)2.
Anoteu la fórmula de l’ió poliatòmic. Aquest enllaç estarà format per més de dos ions. Suposem que esteu treballant en el següent vincle: FeNH4(TAN4)2.  Trobeu la càrrega del metall. Haureu de fer algunes matemàtiques per trobar-les. En primer lloc, sabeu que és sulfat o SO4 ió, té una càrrega de -2 i que n’hi ha dos, a causa dels 2 que hi ha a sota del parèntesi. Per tant, 2x -2 = -4. Llavors ja saps que NH4, o l’ió amoníac, té una càrrega de +1. Afegiu -4 i 1 i obteniu -3. Això significa que l’ió ferro, Fe, ha de tenir una càrrega de +3 per igualar-lo i fer que l’enllaç sigui neutre.
Trobeu la càrrega del metall. Haureu de fer algunes matemàtiques per trobar-les. En primer lloc, sabeu que és sulfat o SO4 ió, té una càrrega de -2 i que n’hi ha dos, a causa dels 2 que hi ha a sota del parèntesi. Per tant, 2x -2 = -4. Llavors ja saps que NH4, o l’ió amoníac, té una càrrega de +1. Afegiu -4 i 1 i obteniu -3. Això significa que l’ió ferro, Fe, ha de tenir una càrrega de +3 per igualar-lo i fer que l’enllaç sigui neutre.  Anoteu el nom del metall. En aquest cas, podeu fer les dues coses Ferro (III) com ferri Escriu a sota.
Anoteu el nom del metall. En aquest cas, podeu fer les dues coses Ferro (III) com ferri Escriu a sota.  Anoteu el nom dels ions no metàl·lics. En aquest cas utilitzeu amoni i sulfat, o sulfat d'amoni.
Anoteu el nom dels ions no metàl·lics. En aquest cas utilitzeu amoni i sulfat, o sulfat d'amoni.  Combineu el nom del metall amb el nom dels no metalls. Podeu anomenar el vincle FeNH4(TAN4)2 donar per o sulfat d’amoni de ferro (III) o bé sulfat d’amoni fèrric escriure.
Combineu el nom del metall amb el nom dels no metalls. Podeu anomenar el vincle FeNH4(TAN4)2 donar per o sulfat d’amoni de ferro (III) o bé sulfat d’amoni fèrric escriure.
Consells
- Si aneu en direcció contrària i teniu números romans, haureu de fer una "radiografia" de la molècula. El número romà és la càrrega del catió.