Autora:
Janice Evans
Data De La Creació:
25 Juliol 2021
Data D’Actualització:
1 Juliol 2024
Content
- Passos
- Part 1 de 2: Components de l'equació iònica
- Part 2 de 2: Escriure equacions iòniques
- Consells
Les equacions iòniques són una part integral de la química. Només contenen aquells components que canvien en el transcurs d’una reacció química. Molt sovint, les equacions iòniques s’utilitzen per descriure reaccions redox, reaccions d’intercanvi i neutralització.L’escriptura d’una equació iònica requereix tres passos bàsics: equilibrar l’equació molecular d’una reacció química, traduir-la en una equació iònica completa (és a dir, escriure els components tal com existeixen en solució) i, finalment, escriure una equació iònica curta.
Passos
Part 1 de 2: Components de l'equació iònica
 1 Comprendre la diferència entre molecular i compostos iònics. Per escriure l’equació iònica, el primer pas és determinar els compostos iònics implicats en la reacció. Les substàncies iòniques són aquelles que es dissocien (es descomponen) en ions carregats en solucions aquoses. Els compostos moleculars no es descomponen en ions. Es componen de dos elements no metàl·lics i de vegades es coneixen com a compostos covalents.
1 Comprendre la diferència entre molecular i compostos iònics. Per escriure l’equació iònica, el primer pas és determinar els compostos iònics implicats en la reacció. Les substàncies iòniques són aquelles que es dissocien (es descomponen) en ions carregats en solucions aquoses. Els compostos moleculars no es descomponen en ions. Es componen de dos elements no metàl·lics i de vegades es coneixen com a compostos covalents. - Els compostos iònics es poden produir entre un metall i un no metall, un metall i ions poliatòmics, o entre diversos ions poliatòmics.
- Si teniu dubtes sobre a quin grup pertany un compost concret, mireu les propietats dels seus elements constitutius a la taula periòdica.
 2 Determineu la solubilitat del compost. No tots els compostos iònics es dissolen en solucions aquoses, és a dir, no tots es dissocien en ions separats. Abans de començar a escriure l’equació, hauríeu de trobar la solubilitat de cada compost. A continuació es mostren breus regles de solubilitat. Podeu trobar més detalls i excepcions a la regla a la taula de dissolució.
2 Determineu la solubilitat del compost. No tots els compostos iònics es dissolen en solucions aquoses, és a dir, no tots es dissocien en ions separats. Abans de començar a escriure l’equació, hauríeu de trobar la solubilitat de cada compost. A continuació es mostren breus regles de solubilitat. Podeu trobar més detalls i excepcions a la regla a la taula de dissolució. - Seguiu les regles en l’ordre en què s’indiquen a continuació:
- totes les sals Na, K i NH4 dissoldre;
- totes les sals NO3, C2H3O2, ClO3 i ClO4 soluble;
- totes les sals Ag, Pb i Hg2 insoluble;
- totes les sals de Cl, Br i I es dissolen;
- sals de CO3, O, S, OH, PO4, CrO4, Cr2O7 i així3 insoluble (amb algunes excepcions);
- Sals SO4 soluble (amb algunes excepcions).
 3 Determineu el catió i l’anió del compost. Els ions amb càrrega positiva (generalment metalls) s’anomenen cations. Els anions tenen una càrrega negativa, generalment ions no metàl·lics. Alguns no metalls poden formar no només anions, sinó també cations, mentre que els àtoms metàl·lics sempre actuen com a cations.
3 Determineu el catió i l’anió del compost. Els ions amb càrrega positiva (generalment metalls) s’anomenen cations. Els anions tenen una càrrega negativa, generalment ions no metàl·lics. Alguns no metalls poden formar no només anions, sinó també cations, mentre que els àtoms metàl·lics sempre actuen com a cations. - Per exemple, en el compost NaCl (sal de taula), el Na és un catió carregat positivament, ja que és un metall i el Cl és un anió carregat negativament, ja que no és un metall.
 4 Determineu els ions poliatòmics (complexos) implicats en la reacció. Aquests ions són molècules carregades, entre els àtoms de les quals hi ha un enllaç tan fort que no es dissocien en reaccions químiques. Cal identificar ions poliatòmics, ja que tenen la seva pròpia càrrega i no decauen en àtoms individuals. Els ions poliatòmics poden tenir càrregues positives i negatives.
4 Determineu els ions poliatòmics (complexos) implicats en la reacció. Aquests ions són molècules carregades, entre els àtoms de les quals hi ha un enllaç tan fort que no es dissocien en reaccions químiques. Cal identificar ions poliatòmics, ja que tenen la seva pròpia càrrega i no decauen en àtoms individuals. Els ions poliatòmics poden tenir càrregues positives i negatives. - Al vostre curs de química general, probablement haureu de memoritzar alguns dels ions poliatòmics més comuns.
- Els ions poliatòmics més comuns són el CO3, NO3, NO2, TAN4, TAN3, ClO4 i ClO3.
- Hi ha molts altres ions poliatòmics que es poden trobar en un llibre de text de química o a Internet.
Part 2 de 2: Escriure equacions iòniques
 1 Equilibri l’equació molecular completa. Abans de començar a escriure l’equació iònica, cal equilibrar l’equació molecular original. Per fer-ho, cal situar els coeficients corresponents davant dels compostos, de manera que el nombre d’àtoms de cada element del costat esquerre sigui igual al seu nombre al costat dret de l’equació.
1 Equilibri l’equació molecular completa. Abans de començar a escriure l’equació iònica, cal equilibrar l’equació molecular original. Per fer-ho, cal situar els coeficients corresponents davant dels compostos, de manera que el nombre d’àtoms de cada element del costat esquerre sigui igual al seu nombre al costat dret de l’equació. - Escriviu el nombre d’àtoms de cada element a banda i banda de l’equació.
- Afegiu coeficients abans dels elements (excepte oxigen i hidrogen) de manera que el nombre d’àtoms de cada element als costats esquerre i dret de l’equació sigui el mateix.
- Equilibri els àtoms d’hidrogen.
- Equilibri els àtoms d’oxigen.
- Compteu el nombre d’àtoms de cada element a banda i banda de l’equació i assegureu-vos que sigui el mateix.
- Per exemple, després d’equilibrar l’equació de Cr + NiCl2 -> CrCl3 + Ni obtenim 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
 2 Determineu l’estat de cada substància que participa en la reacció. Sovint es pot jutjar per la condició del problema. Hi ha certes regles que ajuden a determinar en quin estat es troba un element o una connexió.
2 Determineu l’estat de cada substància que participa en la reacció. Sovint es pot jutjar per la condició del problema. Hi ha certes regles que ajuden a determinar en quin estat es troba un element o una connexió. - Si l'estat d'un element concret no està indicat en l'estat del problema, utilitzeu la taula periòdica per determinar-lo.
- Si la condició diu que el compost està en solució, marqueu-lo (rr).
- Si s'inclou aigua a l'equació, utilitzeu la taula de solubilitat per determinar si el compost iònic es dissociarà. En el cas d’una elevada solubilitat, el compost es dissocia a l’aigua (rr). Si el compost té una solubilitat baixa, es mantindrà sòlid (televisió).
- Si l’aigua no participa en la reacció, el compost iònic es mantindrà en forma sòlida (televisió).
- Si apareix un àcid o una base en el problema, es dissoldran en aigua (rr).
- Com a exemple, considerem la reacció 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. En forma pura, els elements Cr i Ni es troben en fase sòlida. NiCl2 i CrCl3 són compostos iònics solubles, és a dir, estan en dissolució. Per tant, aquesta equació es pot reescriure de la següent manera: 2Cr(televisió) + 3NiCl2(rr) -> 2CrCl3(rr) + 3Ni(televisió).
 3 Determineu quins compostos es dissocien (separats en cations i anions) en solució. Després de la dissociació, el compost es descompon en components positius (catió) i negatius (anions). Aquests components entraran a l’equació iònica de la reacció química.
3 Determineu quins compostos es dissocien (separats en cations i anions) en solució. Després de la dissociació, el compost es descompon en components positius (catió) i negatius (anions). Aquests components entraran a l’equació iònica de la reacció química. - Els sòlids, líquids, gasos, compostos moleculars, compostos iònics amb poca solubilitat, ions poliatòmics i àcids febles no es dissocien.
- Dissocia completament els compostos iònics altament solubles (utilitzeu la taula de solubilitat) i els àcids forts (HCl(rr), HBr(rr), HI(rr), H2TAN4(rr), HClO4(rr) i HNO3(rr)).
- Tingueu en compte que, tot i que els ions poliatòmics no es dissocien, es poden incorporar al compost iònic i separar-ne en solució.
 4 Calculeu la càrrega de cada ió dissociat. En fer-ho, recordeu que els metalls formen cations carregats positivament i que els àtoms no metàl·lics es converteixen en anions negatius. Determineu les càrregues dels elements segons la taula periòdica. També és necessari equilibrar totes les càrregues en compostos neutres.
4 Calculeu la càrrega de cada ió dissociat. En fer-ho, recordeu que els metalls formen cations carregats positivament i que els àtoms no metàl·lics es converteixen en anions negatius. Determineu les càrregues dels elements segons la taula periòdica. També és necessari equilibrar totes les càrregues en compostos neutres. - A l'exemple anterior, NiCl2 es dissocia en Ni i Cl i CrCl3 es descompon en Cr i Cl.
- L’ió níquel té una càrrega de 2+ perquè està unit a dos ions de clor, cadascun amb una sola càrrega negativa. En aquest cas, un ió Ni ha d’equilibrar dos ions Cl carregats negativament. L’ió Cr té una càrrega de 3+, ja que ha de neutralitzar tres ions Cl carregats negativament.
- Recordeu que els ions poliatòmics tenen les seves pròpies càrregues.
 5 Torneu a escriure l’equació de manera que tots els compostos solubles estiguin separats en ions individuals. Tot el que dissoci o ionitzi (com els àcids forts) es divideix en dos ions separats. En aquest cas, la substància romandrà en estat dissolt (rr). Comproveu que l’equació estigui equilibrada.
5 Torneu a escriure l’equació de manera que tots els compostos solubles estiguin separats en ions individuals. Tot el que dissoci o ionitzi (com els àcids forts) es divideix en dos ions separats. En aquest cas, la substància romandrà en estat dissolt (rr). Comproveu que l’equació estigui equilibrada. - Els sòlids, líquids, gasos, àcids febles i compostos iònics amb poca solubilitat no canviaran el seu estat i no se separaran en ions. Deixeu-los com estaven.
- Els compostos moleculars simplement es dispersaran en solució i el seu estat canviarà a dissolt (rr). Hi ha tres compostos moleculars que no anirà a l’estat (rr), això és CH4(G), C3H8(G) i C8H18(f).
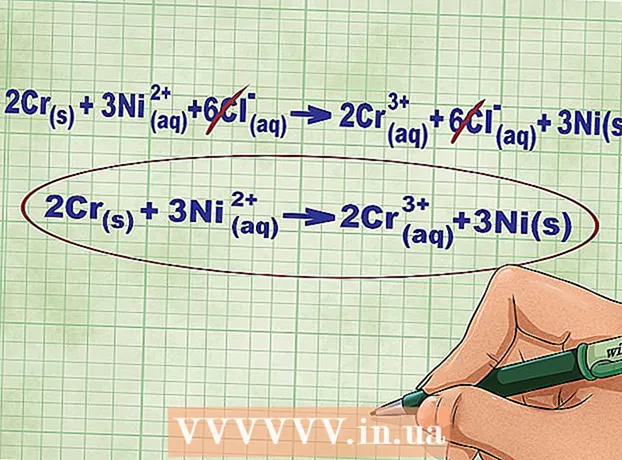
- Per a la reacció que es considera, l'equació iònica completa es pot escriure en la forma següent: 2Cr(televisió) + 3Ni(rr) + 6Cl(rr) -> 2Cr(rr) + 6Cl(rr) + 3Ni(televisió)... Si el clor no forma part del compost, es divideix en àtoms individuals, de manera que multiplicem el nombre d’ions Cl per 6 a banda i banda de l’equació.
 6 Cancel·leu els ions iguals als costats esquerre i dret de l'equació. Només podeu ratllar aquells ions que són completament idèntics a banda i banda de l’equació (tenen les mateixes càrregues, subíndexs, etc.). Torneu a escriure l’equació sense aquests ions.
6 Cancel·leu els ions iguals als costats esquerre i dret de l'equació. Només podeu ratllar aquells ions que són completament idèntics a banda i banda de l’equació (tenen les mateixes càrregues, subíndexs, etc.). Torneu a escriure l’equació sense aquests ions. - En el nostre exemple, els dos costats de l’equació contenen 6 ions Cl que es poden ratllar. Així, obtenim una equació iònica curta: 2Cr(televisió) + 3Ni(rr) -> 2Cr(rr) + 3Ni(televisió).
- Comproveu el resultat. Les càrregues totals dels costats esquerre i dret de l’equació iònica han de ser iguals.
Consells
- Entrena’t sempre escriviu l’estat d’agregació de tots els components en totes les equacions de reaccions químiques.