Autora:
Bobbie Johnson
Data De La Creació:
10 Abril 2021
Data D’Actualització:
1 Juliol 2024
Content
- Passos
- Part 1 de 2: Prepareu l'equip
- Part 2 de 2: realitzeu un experiment
- Consells
- Advertiments
- Què necessites
Procés de divisió d’aigua (H2O) en els seus components (hidrogen i oxigen) mitjançant electricitat s’anomena electròlisi. Els gasos obtinguts com a resultat de l'electròlisi es poden utilitzar sols; per exemple, l'hidrogen serveix com una de les fonts d'energia més netes. Tot i que el nom d’aquest procés pot semblar una mica intel·ligent, en realitat és més fàcil del que podria semblar si teniu l’equip adequat, el coneixement i una mica d’experiència.
Passos
Part 1 de 2: Prepareu l'equip
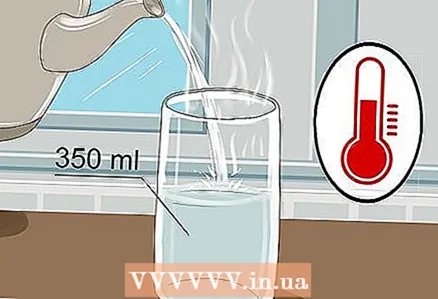 1 Agafeu un got de 350 ml i hi aboqueu aigua tèbia. No cal omplir el got fins a la vora, només hi ha prou aigua. L’aigua freda funcionarà, tot i que l’aigua tèbia condueix millor l’electricitat.
1 Agafeu un got de 350 ml i hi aboqueu aigua tèbia. No cal omplir el got fins a la vora, només hi ha prou aigua. L’aigua freda funcionarà, tot i que l’aigua tèbia condueix millor l’electricitat. - Tant l’aigua de l’aixeta com l’aigua embotellada serviran.
- L’aigua tèbia té una viscositat inferior, cosa que facilita la circulació dels ions.
 2 Dissoleu 1 cullerada (20 grams) de sal de taula en aigua. Aboqueu sal en un got i remeneu l’aigua perquè es dissolgui. Això crearà una solució salina.
2 Dissoleu 1 cullerada (20 grams) de sal de taula en aigua. Aboqueu sal en un got i remeneu l’aigua perquè es dissolgui. Això crearà una solució salina. - El clorur de sodi (és a dir, sal de taula) és un electròlit que augmenta la conductivitat elèctrica de l’aigua. Per si sola, l’aigua no condueix bé l’electricitat.
- Després d’augmentar la conductivitat elèctrica de l’aigua, el corrent creat per la bateria passarà més fàcilment per la solució i descompondrà les molècules de manera més eficaç en hidrogen i oxigen.
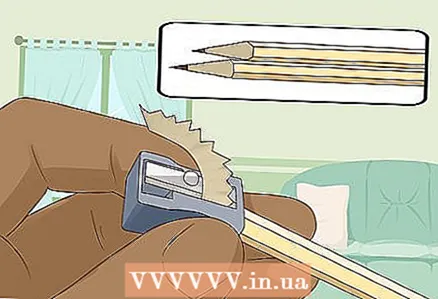 3 Afineu dos llapis suaus i durs als dos extrems per exposar el plom. No oblideu treure la goma d'esborrar dels llapis. Una barra de grafit hauria de sobresortir pels dos extrems.
3 Afineu dos llapis suaus i durs als dos extrems per exposar el plom. No oblideu treure la goma d'esborrar dels llapis. Una barra de grafit hauria de sobresortir pels dos extrems. - Les barres de grafit serviran com a elèctrodes aïllats als quals connecteu la bateria.
- El grafit és molt adequat per a aquest experiment, ja que no es dissol ni es corroix a l’aigua.
 4 Retalleu un full de cartró prou gran com per posar-lo damunt del got. Utilitzeu un tros de cartró bastant gruixut que no caigui després de perforar-hi dos forats. Talla una peça quadrada d’una caixa de sabates o similar.
4 Retalleu un full de cartró prou gran com per posar-lo damunt del got. Utilitzeu un tros de cartró bastant gruixut que no caigui després de perforar-hi dos forats. Talla una peça quadrada d’una caixa de sabates o similar. - El cartró s’utilitza per subjectar els llapis a l’aigua perquè no toquin els laterals i el fons del got.
- El cartró no és conductor, de manera que podeu posar-lo amb seguretat sobre un got.
 5 Utilitzeu llapis per ficar dos forats al cartró. Traieu el cartró amb llapis; en aquest cas, quedaran ben subjectes i no rellisquin. Assegureu-vos que el grafit no toqui els costats o la part inferior del vidre, en cas contrari interferirà amb l’experiment.
5 Utilitzeu llapis per ficar dos forats al cartró. Traieu el cartró amb llapis; en aquest cas, quedaran ben subjectes i no rellisquin. Assegureu-vos que el grafit no toqui els costats o la part inferior del vidre, en cas contrari interferirà amb l’experiment.
Part 2 de 2: realitzeu un experiment
 1 Connecteu un cable amb clips de cocodril a cada terminal de la bateria. La bateria servirà com a font de corrent elèctric i, a través dels cables amb pinces i barres de grafit, el corrent arribarà a l’aigua.Connecteu un cable amb una pinça al positiu i l’altre al terminal negatiu de la bateria.
1 Connecteu un cable amb clips de cocodril a cada terminal de la bateria. La bateria servirà com a font de corrent elèctric i, a través dels cables amb pinces i barres de grafit, el corrent arribarà a l’aigua.Connecteu un cable amb una pinça al positiu i l’altre al terminal negatiu de la bateria. - Utilitzeu una bateria de 6 volts. Si no en teniu cap, podeu utilitzar una bateria de 9 volts.
- Es pot obtenir una bateria adequada en un supermercat o botiga de subministraments elèctrics.
 2 Connecteu els altres extrems dels cables als llapis. Col·loqueu fermament les brides metàl·liques a les barres de grafit. És possible que hagueu de desprendre una mica més de fusta dels llapis per evitar que els clips llisquin de les barres de grafit.
2 Connecteu els altres extrems dels cables als llapis. Col·loqueu fermament les brides metàl·liques a les barres de grafit. És possible que hagueu de desprendre una mica més de fusta dels llapis per evitar que els clips llisquin de les barres de grafit. - Així, tancareu el circuit i el corrent de la bateria fluirà per l’aigua.
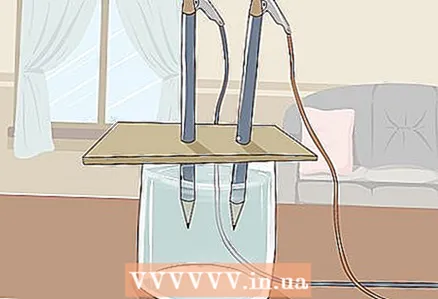 3 Col·loqueu el cartró sobre el got de manera que els extrems lliures dels llapis quedin submergits a l’aigua. El full de cartró ha de ser prou gran com per descansar sobre el vidre. Aneu amb compte de no molestar la correcta col·locació dels llapis.
3 Col·loqueu el cartró sobre el got de manera que els extrems lliures dels llapis quedin submergits a l’aigua. El full de cartró ha de ser prou gran com per descansar sobre el vidre. Aneu amb compte de no molestar la correcta col·locació dels llapis. - Perquè l’experiment tingui èxit, el grafit no ha de tocar les parets i el fons del vidre. Torneu a comprovar-ho i ajusteu els llapis si cal.
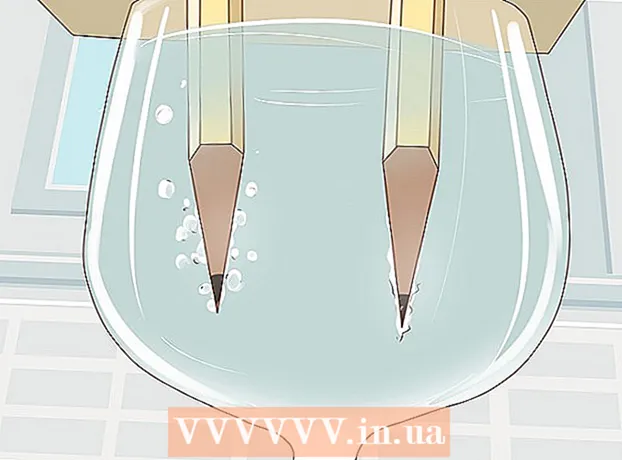
 4 Mireu com l'aigua es divideix en hidrogen i oxigen. Les bombolles de gas començaran a pujar a partir de les barres de grafit submergides a l’aigua. Són hidrogen i oxigen. L’hidrogen s’alliberarà al pol negatiu i l’oxigen al pol positiu.
4 Mireu com l'aigua es divideix en hidrogen i oxigen. Les bombolles de gas començaran a pujar a partir de les barres de grafit submergides a l’aigua. Són hidrogen i oxigen. L’hidrogen s’alliberarà al pol negatiu i l’oxigen al pol positiu. - Tan bon punt connecteu els cables a la bateria i a les barres de grafit, correrà un corrent elèctric per l’aigua.
- Es formaran més bombolles de gas al llapis connectat al pol negatiu, ja que cada molècula d’aigua està formada per dos àtoms d’hidrogen i un d’oxigen.
Consells
- Si no teniu llapis amb eixos de grafit, podeu utilitzar dos cables petits. Simplement envolteu un extrem de cada cable al voltant del pal de la bateria corresponent i submergiu l’altre a l’aigua. El resultat serà el mateix que amb els llapis.
- Proveu d’utilitzar una bateria diferent. La quantitat de corrent que flueix depèn de la tensió de la bateria, que, al seu torn, afecta la velocitat de divisió de les molècules d'aigua.
Advertiments
- Si afegiu un electròlit, com ara sal, a l’aigua, tingueu en compte que l’experiment generarà una petita quantitat d’un subproducte com el clor. És segur en quantitats tan petites, però es pot sentir una olor lleu a clor.
- Realitzeu aquest experiment sota la supervisió d'un adult. S'associa amb electricitat i gasos i, per tant, pot ser perillós, encara que improbable.
Què necessites
- Dos llapis suaus i durs
- Una bateria de 6 o 9 volts
- Vidre amb un volum de 350 mil·lilitres
- 2 cables amb clips de cocodril
- Afilador per a llapis
- Sal