Autora:
Carl Weaver
Data De La Creació:
22 Febrer 2021
Data D’Actualització:
1 Juliol 2024
Content
- Passos
- Mètode 1 de 2: Calculeu el coeficient d’absorció molar mitjançant la fórmula
- Mètode 2 de 2: Trobada gràfica del coeficient d’absorció molar
- Articles addicionals
El coeficient d’absorció molar, també conegut com a coeficient d’extinció molar, és una mesura de la intensitat de les partícules químiques (molècules) d’una substància que absorbeixen la llum a una longitud d’ona específica. Cada substància es caracteritza pel seu propi coeficient d’absorció molar, que és independent de la concentració i el volum. Aquesta característica s’utilitza àmpliament en química i no s’ha de confondre amb el coeficient d’extinció, que s’utilitza més habitualment en física. La unitat estàndard de mesura de l’absorbància molar és el litre dividit per mol i per centímetre (L mol cm).
Passos
Mètode 1 de 2: Calculeu el coeficient d’absorció molar mitjançant la fórmula
 1 Consulteu la llei Bouguer-Lambert-Beer:A = ɛlc... L'equació descriu l'absorció de llum en un medi A = ɛlc, on A - la quantitat de llum d'una determinada longitud d'ona que va ser absorbida per la mostra, ɛ - coeficient d’absorció molar, l és la distància recorreguda per la llum en solució, i c - la concentració de la solució (el nombre de molècules estudiades per unitat de volum).
1 Consulteu la llei Bouguer-Lambert-Beer:A = ɛlc... L'equació descriu l'absorció de llum en un medi A = ɛlc, on A - la quantitat de llum d'una determinada longitud d'ona que va ser absorbida per la mostra, ɛ - coeficient d’absorció molar, l és la distància recorreguda per la llum en solució, i c - la concentració de la solució (el nombre de molècules estudiades per unitat de volum). - El coeficient d’absorció també es pot trobar a partir de la relació entre la intensitat de la llum transmesa a través de l’estàndard i la mostra objecte d’estudi. En aquest cas, l’equació és la següent: A = registre10(Joo/ Jo).
- La intensitat de la llum es determina mitjançant un espectrofotòmetre.
- La capacitat d’absorció d’una solució depèn de la longitud d’ona de la llum que la travessa. En certs valors de la longitud d’ona, la llum s’absorbeix amb més força que en altres, i aquests valors depenen de la composició de la solució. A l’hora de calcular, no oblideu indicar quina longitud d’ona es fabrica.
 2 Convertiu la llei de Bouguer-Lambert-Beer per expressar el coeficient d’absorció molar. Dividiu els dos costats de l'equació per longitud i concentració, i el resultat és una expressió del coeficient d'absorció molar: ɛ = A / lc... Mitjançant aquesta fórmula, podeu calcular el coeficient d’absorció molar d’una longitud d’ona específica.
2 Convertiu la llei de Bouguer-Lambert-Beer per expressar el coeficient d’absorció molar. Dividiu els dos costats de l'equació per longitud i concentració, i el resultat és una expressió del coeficient d'absorció molar: ɛ = A / lc... Mitjançant aquesta fórmula, podeu calcular el coeficient d’absorció molar d’una longitud d’ona específica. - La capacitat d’absorció a distància fixa depèn de la concentració de la solució i de la forma del recipient utilitzat. El coeficient d’absorció molar elimina aquests factors.
 3 Mesureu els valors necessaris mitjançant l'espectrofotometria. En un espectrofotòmetre, la llum amb una longitud d'ona específica es fa passar per una substància i la intensitat de la llum transmesa es mesura a la sortida. Part de la llum és absorbida per la solució i la intensitat de la llum disminueix. L’espectrofotòmetre mesura la intensitat de la llum transmesa, que s’utilitza per calcular el coeficient d’absorció molar.
3 Mesureu els valors necessaris mitjançant l'espectrofotometria. En un espectrofotòmetre, la llum amb una longitud d'ona específica es fa passar per una substància i la intensitat de la llum transmesa es mesura a la sortida. Part de la llum és absorbida per la solució i la intensitat de la llum disminueix. L’espectrofotòmetre mesura la intensitat de la llum transmesa, que s’utilitza per calcular el coeficient d’absorció molar. - Prepareu una solució de concentració coneguda per a l'anàlisi c... Determineu la concentració en unitats de mol / gram o mol / litre.
- Per determinar l mesura la longitud de la cubeta utilitzada. Anoteu la longitud en centímetres.
- Mesureu l’absorbància amb un espectrofotòmetre A per a una longitud d'ona específica. La longitud d’ona es mesura en metres, però la llum és tan curta que normalment s’expressa en nanòmetres (nm). La capacitat d’absorció és adimensional.
 4 Connecteu els números a l’equació i trobeu el coeficient d’absorció molar. Preneu valors numèrics A, c i l i connecteu-los a la fórmula ɛ = A / lc... Multiplicar l al ci després divideix A per aquesta quantitat, es troba el coeficient d’absorció molar.
4 Connecteu els números a l’equació i trobeu el coeficient d’absorció molar. Preneu valors numèrics A, c i l i connecteu-los a la fórmula ɛ = A / lc... Multiplicar l al ci després divideix A per aquesta quantitat, es troba el coeficient d’absorció molar. - Suposem que heu mesurat l’absorbància d’una solució de 0,05 mol / litre amb una cubeta d’1 cm. En aquest cas, l’absorbància era de 1,5 per a la llum amb una longitud d’ona de 280 nm. Com es pot trobar el coeficient d’absorció molar d’una solució determinada?
- ɛ280 = A / lc = 1,5 / (1 x 0,05) = 30 L mol cm
- Suposem que heu mesurat l’absorbància d’una solució de 0,05 mol / litre amb una cubeta d’1 cm. En aquest cas, l’absorbància era de 1,5 per a la llum amb una longitud d’ona de 280 nm. Com es pot trobar el coeficient d’absorció molar d’una solució determinada?
Mètode 2 de 2: Trobada gràfica del coeficient d’absorció molar
 1 Mesureu la intensitat de la llum transmesa per a diferents concentracions de la solució. Prepareu 3-4 solucions amb concentracions diferents.Mitjançant un espectrofotòmetre, mesureu l’absorbància de solucions de diferents concentracions per a una longitud d’ona determinada. Podeu començar amb la solució de concentració més baixa. L’ordre no és important, el més important és no confondre i registrar els valors d’absorbància mesurats d’acord amb les concentracions.
1 Mesureu la intensitat de la llum transmesa per a diferents concentracions de la solució. Prepareu 3-4 solucions amb concentracions diferents.Mitjançant un espectrofotòmetre, mesureu l’absorbància de solucions de diferents concentracions per a una longitud d’ona determinada. Podeu començar amb la solució de concentració més baixa. L’ordre no és important, el més important és no confondre i registrar els valors d’absorbància mesurats d’acord amb les concentracions.  2 Representa els gràfics els valors obtinguts. Representa la concentració a l’eix horitzontal X i l’absorbància a l’eix vertical Y i traça les mesures com a punts.
2 Representa els gràfics els valors obtinguts. Representa la concentració a l’eix horitzontal X i l’absorbància a l’eix vertical Y i traça les mesures com a punts. - Dibuixa una línia entre els punts. Si les mesures es van fer correctament, els punts haurien de situar-se en una línia recta, ja que, segons la llei de Bouguer-Lambert-Beer, la capacitat d’absorció és directament proporcional a la concentració.
 3 Definiu pendent rectepassant pels punts experimentals. Per trobar el pendent d’una recta, divideix l’increment Y per l’increment d’abscisses X. Agafa dos punts de la línia, resta les coordenades corresponents d’un punt de les coordenades de l’altre i divideix la diferència Y per la diferència X.
3 Definiu pendent rectepassant pels punts experimentals. Per trobar el pendent d’una recta, divideix l’increment Y per l’increment d’abscisses X. Agafa dos punts de la línia, resta les coordenades corresponents d’un punt de les coordenades de l’altre i divideix la diferència Y per la diferència X. - El pendent d’una línia recta (el pendent o la tangent del pendent) es troba de la següent manera: (Y2 - Sí1) / (X2 - X1). En aquest cas, al punt situat més amunt al llarg de la línia recta se li assigna l’índex 2 i el punt inferior, l’índex 1.
- Suposem que a una concentració molar de 0,2 l’absorbància era de 0,27 i a una concentració de 0,3 era de 0,41. L’absorbància es representa a l’eix Y i la concentració a l’eix X. Utilitzant l’equació anterior, trobeu el pendent d’una línia recta: (Y2 - Sí1) / (X2 - X1) = (0,41-0,27)/(0,3-0,2) = 0,14/0,1 = 1,4.
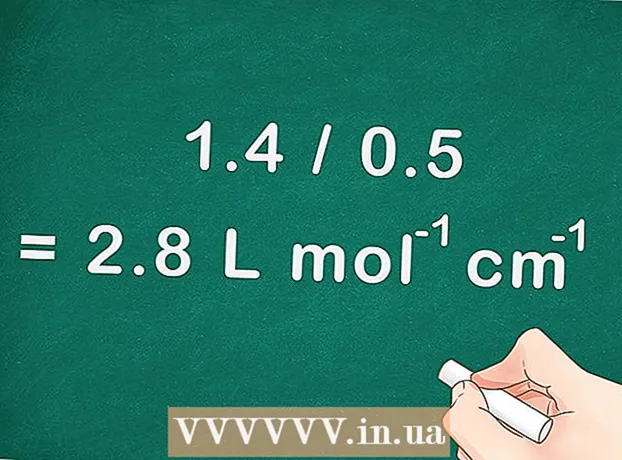
 4 Per trobar el coeficient d’absorció molar, divideix el pendent d’una línia recta pel camí recorregut per la llum (profunditat de la cubeta). El recorregut de la llum és igual a la profunditat de la cubeta utilitzada a l’espectrofotòmetre.
4 Per trobar el coeficient d’absorció molar, divideix el pendent d’una línia recta pel camí recorregut per la llum (profunditat de la cubeta). El recorregut de la llum és igual a la profunditat de la cubeta utilitzada a l’espectrofotòmetre. - Per al nostre exemple, obtenim: si el pendent és 1,4 i la profunditat de la cubeta és de 0,5 centímetres, el coeficient d’absorció molar és 1,4 / 0,5 = 2,8 L mol cm.
Articles addicionals
 Com es calculen metres quadrats
Com es calculen metres quadrats  Com es pot trobar el nombre de protons, neutrons i electrons
Com es pot trobar el nombre de protons, neutrons i electrons  Com es determinen els electrons de valència
Com es determinen els electrons de valència  Com equilibrar les equacions químiques
Com equilibrar les equacions químiques  Com escriure la configuració electrònica d’un àtom de qualsevol element
Com escriure la configuració electrònica d’un àtom de qualsevol element  Com es calcula la concentració d’una solució
Com es calcula la concentració d’una solució  Com es calcula la molaritat d’una solució
Com es calcula la molaritat d’una solució  Com es pot trobar el nombre de neutrons en un àtom
Com es pot trobar el nombre de neutrons en un àtom  Com fer aigua potable a partir de sal
Com fer aigua potable a partir de sal  Com s'utilitza la taula periòdica
Com s'utilitza la taula periòdica  Com guardar el gel sec
Com guardar el gel sec  Com fer gel sec
Com fer gel sec  Com fer pasta de dents d’elefant
Com fer pasta de dents d’elefant  Com diluir la solució
Com diluir la solució



