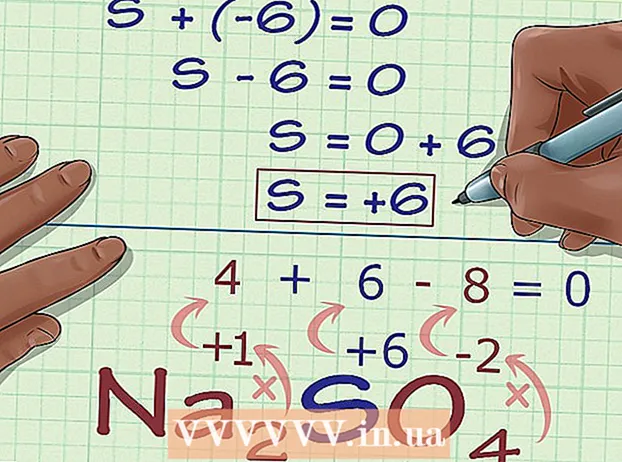
Content
- Per trepitjar
- Part 1 de 2: Assignació de nombres d'oxidació basats en regles químiques
- Part 2 de 2: Assignació de nombres a àtoms sense les regles dels nombres d’oxidació
- Consells
- Necessitats
En química, els termes "oxidació" i "reducció" signifiquen aquelles reaccions en què un àtom (o grup d'àtoms) perd o guanya electrons, respectivament. Els nombres d’oxidació són nombres assignats a àtoms (o grups d’àtoms) per ajudar els químics a controlar quants electrons es poden desplaçar i si els reactius donats s’oxiden o redueixen durant una reacció. El procés d’assignació de nombres d’oxidació als àtoms pot anar des de molt simple fins a més complex, en funció de la càrrega dels àtoms i de la composició química de les molècules de les quals formen part. Per fer les coses més complicades, alguns àtoms poden tenir múltiples nombres d’oxidació. Afortunadament, l’assignació de nombres d’oxidació es regeix per regles clarament definides i fàcils de seguir, però la comprensió bàsica de la química i l’àlgebra facilitarà molt l’ús d’aquestes regles.
Per trepitjar
Part 1 de 2: Assignació de nombres d'oxidació basats en regles químiques
 Determineu si la substància en qüestió és elemental. Els àtoms lliures i no units sempre tenen un nombre d’oxidació de 0. Això és cert tant per als àtoms que consisteixen en un únic àtom com per als àtoms la forma elemental dels quals és diatòmica o poliatòmica.
Determineu si la substància en qüestió és elemental. Els àtoms lliures i no units sempre tenen un nombre d’oxidació de 0. Això és cert tant per als àtoms que consisteixen en un únic àtom com per als àtoms la forma elemental dels quals és diatòmica o poliatòmica. - Per exemple, Al(s) i Cl2 tots dos tenen el nombre d’oxidació de 0 perquè no són àtoms compostos.
- Tingueu en compte que el sofre en la seva forma elemental, S.8 (octasulfur), encara que irregular, també té un nombre d’oxidació de 0.
 Determineu si la substància en qüestió és un ió. Els ions tenen números d’oxidació iguals a la seva càrrega. Això és cert tant en els ions no units com en els ions que formen part d’un ió compost.
Determineu si la substància en qüestió és un ió. Els ions tenen números d’oxidació iguals a la seva càrrega. Això és cert tant en els ions no units com en els ions que formen part d’un ió compost. - Per exemple, l’ió Cl té un nombre d’oxidació de -1.
- L’ió Cl encara té un nombre d’oxidació de -1 quan forma part del compost NaCl. Com que l’ió Na, per definició, té una càrrega de +1, sabem que l’ió Cl té una càrrega de -1, de manera que el nombre d’oxidació és encara -1.
 En el cas dels ions metàl·lics, és bo recordar que són possibles múltiples nombres d’oxidació. Molts metalls poden tenir més d’un replà. Per exemple, el ferro metàl·lic (Fe) pot ser un ió amb càrrega +2 o +3. la càrrega dels ions metàl·lics (i, per tant, els seus nombres d’oxidació) es pot determinar en relació amb la càrrega dels altres àtoms en la composició de la qual formen part, o, quan s’escriu com a text, per la notació en números romans (com ara la frase: "L'ió ferro (III) té una càrrega de +3.").
En el cas dels ions metàl·lics, és bo recordar que són possibles múltiples nombres d’oxidació. Molts metalls poden tenir més d’un replà. Per exemple, el ferro metàl·lic (Fe) pot ser un ió amb càrrega +2 o +3. la càrrega dels ions metàl·lics (i, per tant, els seus nombres d’oxidació) es pot determinar en relació amb la càrrega dels altres àtoms en la composició de la qual formen part, o, quan s’escriu com a text, per la notació en números romans (com ara la frase: "L'ió ferro (III) té una càrrega de +3."). - Per exemple, fem una ullada a un compost que conté un ió d'alumini. El compost AlCl3 té una càrrega de 0. Com que sabem que els ions Cl tenen una càrrega de -1 i que hi ha 3 ions Cl en el compost, l’ió Al ha de tenir una càrrega de +3, de manera que la càrrega de tots els ions sumats és 0. Per tant, el nombre d’oxidació d’Al és +3.
 Assigneu un número d’oxidació -2 a l’oxigen (amb excepcions). En gairebé en tots els casos, els àtoms d’oxigen tenen un nombre d’oxidació de -2. Hi ha algunes excepcions a aquesta regla:
Assigneu un número d’oxidació -2 a l’oxigen (amb excepcions). En gairebé en tots els casos, els àtoms d’oxigen tenen un nombre d’oxidació de -2. Hi ha algunes excepcions a aquesta regla: - Quan l’oxigen es troba en estat elemental (O2), llavors el nombre d’oxidació és igual a 0, que és el cas de tots els àtoms elementals.
- Quan l’oxigen forma part peròxid, llavors el nombre d’oxidació és -1. Els peròxids són una classe de compostos que tenen un enllaç oxigen-oxigen (o l’anió peròxid d’oxigen O)2). Per exemple, a la molècula H2O2 (peròxid d’hidrogen), l’oxigen té un nombre d’oxidació (i una càrrega) de -1.A més, quan l’oxigen forma part d’un superòxid, el nombre d’oxidació és -0,5.
- Quan l’oxigen està unit al fluor, el nombre d’oxidació és +2. Consulteu la regla de fluor següent per obtenir més informació. A (O2F.2) és +1.
 Assigneu un nombre d’oxidació de +1 a l’hidrogen (amb excepcions). Igual que amb l’oxigen, el nombre d’oxidació de l’hidrogen depèn de casos excepcionals. En general, l’hidrogen té un número d’oxidació +1 (excepte en forma elemental, H.2). Però en el cas d’un compost especial anomenat híbrids, l’hidrogen té un nombre d’oxidació de -1.
Assigneu un nombre d’oxidació de +1 a l’hidrogen (amb excepcions). Igual que amb l’oxigen, el nombre d’oxidació de l’hidrogen depèn de casos excepcionals. En general, l’hidrogen té un número d’oxidació +1 (excepte en forma elemental, H.2). Però en el cas d’un compost especial anomenat híbrids, l’hidrogen té un nombre d’oxidació de -1. - Per exemple, de H2Ah, sabem que l’hidrogen té un nombre d’oxidació de +1 perquè l’oxigen té una càrrega de -2 i necessitem 2 +1 càrregues per formar un compost amb una càrrega total de zero. Però amb la substància hidrur sòdic, NaH, l’hidrogen té un número d’oxidació -1 perquè l’ió Na té una càrrega de +1 i, per fer la càrrega total del compost 0, l’hidrogen té una càrrega (i, per tant, un nombre d’oxidació) de -1.
 Fluor sempre un nombre d’oxidació de -1. Com s’ha indicat anteriorment, el nombre d’oxidació de certs elements pot variar a causa de diversos factors (ions metàl·lics, àtoms d’oxigen en peròxids, etc.). El fluor, en canvi, té un nombre d’oxidació de -1, i això no canvia mai. Això es deu al fet que el fluor és l’element més electro-negatiu o, dit d’una altra manera, és l’element que està menys disposat a abandonar els electrons i és més probable que agafi els electrons d’altres àtoms. Per tant, el nombre d’oxidació no canviarà.
Fluor sempre un nombre d’oxidació de -1. Com s’ha indicat anteriorment, el nombre d’oxidació de certs elements pot variar a causa de diversos factors (ions metàl·lics, àtoms d’oxigen en peròxids, etc.). El fluor, en canvi, té un nombre d’oxidació de -1, i això no canvia mai. Això es deu al fet que el fluor és l’element més electro-negatiu o, dit d’una altra manera, és l’element que està menys disposat a abandonar els electrons i és més probable que agafi els electrons d’altres àtoms. Per tant, el nombre d’oxidació no canviarà.  Els nombres d’oxidació d’un compost són iguals a la càrrega del compost. Els nombres d’oxidació de tots els àtoms d’un compost són iguals a la càrrega d’aquest compost. Per exemple, si un compost no té cap càrrega, la suma de tots els nombres d’oxidació serà zero; si el compost és un ió poliatòmic amb una càrrega de -1, els nombres d’oxidació afegits han de ser -1, etc.
Els nombres d’oxidació d’un compost són iguals a la càrrega del compost. Els nombres d’oxidació de tots els àtoms d’un compost són iguals a la càrrega d’aquest compost. Per exemple, si un compost no té cap càrrega, la suma de tots els nombres d’oxidació serà zero; si el compost és un ió poliatòmic amb una càrrega de -1, els nombres d’oxidació afegits han de ser -1, etc. - Aquesta és una bona manera de comprovar la vostra resposta: si els nombres d'oxidació d'un compost no són iguals a la càrrega d'aquest compost, llavors sabeu que heu comès un error.
Part 2 de 2: Assignació de nombres a àtoms sense les regles dels nombres d’oxidació
 Trobeu àtoms sense regles de número d’oxidació. Alguns àtoms no segueixen les regles per trobar nombres d’oxidació. Si un àtom no compleix les regles anteriors i no esteu segur de quina és la seva càrrega (per exemple, si forma part d’un compost més gran de manera que es desconeix la càrrega individual), podeu trobar el nombre d’oxidació d’aquest àtom eliminació. Primer heu de determinar quina és l’oxidació de tots els altres àtoms del compost. Aleshores resoldreu la suma de la incògnita de l’equació, basant-vos en la càrrega total del compost.
Trobeu àtoms sense regles de número d’oxidació. Alguns àtoms no segueixen les regles per trobar nombres d’oxidació. Si un àtom no compleix les regles anteriors i no esteu segur de quina és la seva càrrega (per exemple, si forma part d’un compost més gran de manera que es desconeix la càrrega individual), podeu trobar el nombre d’oxidació d’aquest àtom eliminació. Primer heu de determinar quina és l’oxidació de tots els altres àtoms del compost. Aleshores resoldreu la suma de la incògnita de l’equació, basant-vos en la càrrega total del compost. - Per exemple, en el compost Na2TAN4, la càrrega de sofre (S) és desconeguda: no es troba en la seva forma elemental, de manera que no és 0, però això és tot el que sabem. Aquest és un bon candidat per aplicar aquest mètode per determinar el nombre d’oxidació algebraicament.
 Determineu els nombres d’oxidació coneguts dels altres elements del compost. Mitjançant les regles d’assignació de nombres d’oxidació, determinem quins nombres d’oxidació tenen els altres àtoms del compost. Tingueu en compte les excepcions com ara O, H, etc.
Determineu els nombres d’oxidació coneguts dels altres elements del compost. Mitjançant les regles d’assignació de nombres d’oxidació, determinem quins nombres d’oxidació tenen els altres àtoms del compost. Tingueu en compte les excepcions com ara O, H, etc. - A Na2TAN4, sabem, basant-nos en el nostre conjunt de regles, que l’ió Na té una càrrega (i, per tant, un nombre d’oxidació) de +1 i que els àtoms d’oxigen tenen números d’oxidació de -2.
 Multiplicar el nombre de cada àtom pel nombre d’oxidació. Ara que coneixem els nombres d’oxidació de tots els àtoms, excepte el desconegut, haurem de considerar que alguns d’aquests àtoms poden produir-se més d’una vegada. Multiplicar cada coeficient (escrit en subíndex després del símbol de l'àtom en el compost) pel nombre d'oxidació.
Multiplicar el nombre de cada àtom pel nombre d’oxidació. Ara que coneixem els nombres d’oxidació de tots els àtoms, excepte el desconegut, haurem de considerar que alguns d’aquests àtoms poden produir-se més d’una vegada. Multiplicar cada coeficient (escrit en subíndex després del símbol de l'àtom en el compost) pel nombre d'oxidació. - Pel que fa a Na2TAN4, sabem que hi ha 2 àtoms de Na i 4 àtoms d’O. Ara fem el següent càlcul, 2 × +1, per obtenir el nombre d’oxidació de Na, 2 i multiplicem 4 × -2, el nombre d’oxidació d’O, -8.
 Sumeu els resultats. Sumant els resultats d’aquestes multiplicacions es dóna el nombre d’oxidació del compost, sense tenint en compte el nombre d’oxidació de l’àtom desconegut.
Sumeu els resultats. Sumant els resultats d’aquestes multiplicacions es dóna el nombre d’oxidació del compost, sense tenint en compte el nombre d’oxidació de l’àtom desconegut. - En el nostre exemple amb Na2TAN4, afegim 2 a -8 per obtenir -6.
 Calculeu el nombre d’oxidació desconegut en funció de la càrrega del compost. Ara teniu totes les dades per trobar el nombre d’oxidació desconegut mitjançant una àlgebra senzilla. Utilitzarem una equació i la resposta del pas anterior, més la càrrega del compost. En altres paraules: (Suma dels números d'oxidació desconeguts) + (el nombre d'oxidació desconegut que voleu saber) = (càrrega del compost).
Calculeu el nombre d’oxidació desconegut en funció de la càrrega del compost. Ara teniu totes les dades per trobar el nombre d’oxidació desconegut mitjançant una àlgebra senzilla. Utilitzarem una equació i la resposta del pas anterior, més la càrrega del compost. En altres paraules: (Suma dels números d'oxidació desconeguts) + (el nombre d'oxidació desconegut que voleu saber) = (càrrega del compost).- A l'exemple de Na2TAN4, ho resolem de la següent manera:
- (Suma de nombres d'oxidació coneguts) + (nombre d'oxidació desconegut que voleu resoldre) = (càrrega del compost)
- -6 + S = 0
- S = 0 + 6
- S = 6. S té un nombre d’oxidació o 6 a Na2TAN4.
- A l'exemple de Na2TAN4, ho resolem de la següent manera:
Consells
- Els àtoms en la seva forma bàsica sempre tenen un nombre d’oxidació de 0. Un ió que consta d’un àtom té un nombre d’oxidació igual a la càrrega. Els metalls del grup 1A com l’hidrogen, el liti i el sodi tenen un número d’oxidació +1; Els metalls del grup 2A, com el magnesi i el calci, tenen un nombre d’oxidació de +2. Tant l’hidrogen com l’oxigen poden tenir 2 nombres d’oxidació diferents, segons el seu enllaç.
- En un compost, la suma de tots els nombres d’oxidació hauria de ser igual a 0. Si hi ha un ió amb 2 àtoms, la suma dels nombres d’oxidació hauria de ser igual a la càrrega de l’ió.
- És molt útil saber llegir la taula periòdica i on trobar els metalls i els no metalls.
Necessitats
- Taula periòdica dels elements
- Una connexió a Internet
- Un llibre de química
- Paper, bolígraf o llapis
- Calculadora