Autora:
Frank Hunt
Data De La Creació:
13 Març 2021
Data D’Actualització:
1 Juliol 2024
Content
- Per trepitjar
- Mètode 1 de 3: utilitzar un mesurador de pH
- Mètode 2 de 3: amb paper de tornasol
- Mètode 3 de 3: comprensió del pH
És important mesurar el pH (el grau d’acidesa o alcalinitat) de l’aigua. L’aigua l’utilitzen les plantes i els animals dels quals depenem i la bevem cada dia. El valor del pH de l’aigua pot ser una indicació d’una possible contaminació, de manera que mesurar el pH de l’aigua pot ser una important precaució per a la salut pública.
Per trepitjar
Mètode 1 de 3: utilitzar un mesurador de pH
 Calibreu la sonda i el mesurador segons les instruccions de fàbrica. És possible que hàgiu de calibrar el mesurador amb una substància amb un valor de pH conegut. El mesurador es pot ajustar segons aquesta substància. Si aneu a provar aigua fora d’un laboratori, es recomana realitzar aquest calibratge unes hores abans de les proves de camp.
Calibreu la sonda i el mesurador segons les instruccions de fàbrica. És possible que hàgiu de calibrar el mesurador amb una substància amb un valor de pH conegut. El mesurador es pot ajustar segons aquesta substància. Si aneu a provar aigua fora d’un laboratori, es recomana realitzar aquest calibratge unes hores abans de les proves de camp. - Esbandiu la sonda amb aigua neta abans d'utilitzar-la. Assecar amb un drap net.
 Agafeu una mostra d’aigua i aboqueu-la a un recipient net.
Agafeu una mostra d’aigua i aboqueu-la a un recipient net.- L’aigua ha de ser prou profunda per submergir la punta de l’elèctrode.
- Deixeu la mostra una estona perquè la temperatura s’estabilitzi.
- Mesureu la temperatura de la mostra amb un termòmetre.
 Ajusteu el comptador amb la temperatura de la mostra. La temperatura de l'aigua afecta la sensibilitat de la sonda, de manera que la mesura només pot ser precisa si introduïu les dades de temperatura.
Ajusteu el comptador amb la temperatura de la mostra. La temperatura de l'aigua afecta la sensibilitat de la sonda, de manera que la mesura només pot ser precisa si introduïu les dades de temperatura.  Col·loqueu la sonda a la mostra. Espereu fins que l’indicador arribi a l’equilibri. El mesurador es troba en estat estacionari quan la lectura és estable.
Col·loqueu la sonda a la mostra. Espereu fins que l’indicador arribi a l’equilibri. El mesurador es troba en estat estacionari quan la lectura és estable.  Llegiu la mesura del pH de la mostra. El mesurador de pH dóna el resultat en una escala de 0-14. Si l’aigua és pura, el valor és al voltant de 7. Escriviu les vostres conclusions.
Llegiu la mesura del pH de la mostra. El mesurador de pH dóna el resultat en una escala de 0-14. Si l’aigua és pura, el valor és al voltant de 7. Escriviu les vostres conclusions.
Mètode 2 de 3: amb paper de tornasol
 Conegueu la diferència entre el paper pH i el paper tornasol. Podeu utilitzar paper pH per obtenir una lectura precisa d’una mostra. Tanmateix, el paper pH no s’ha de confondre amb el paper tornasol normal. Tots dos es poden utilitzar per provar àcids i bases, però difereixen en aspectes importants.
Conegueu la diferència entre el paper pH i el paper tornasol. Podeu utilitzar paper pH per obtenir una lectura precisa d’una mostra. Tanmateix, el paper pH no s’ha de confondre amb el paper tornasol normal. Tots dos es poden utilitzar per provar àcids i bases, però difereixen en aspectes importants. - Les tires de pH contenen una sèrie de barres indicadores que canvien de color quan s’exposen a una solució. La força dels àcids i les bases de cada barra difereix. Després del canvi, es pot comparar el patró de color amb les mostres subministrades amb el kit.
- El paper de tornasol és una tira de paper que conté un àcid o una base (alcalina). Les franges més habituals són el vermell (amb un àcid que reacciona amb les bases) i el blau (amb una base que reacciona amb els àcids). Les ratlles vermelles es tornen blaves si la substància és alcalina i les ratlles blaves es tornen vermelles si la substància és àcida. Els papers de tornasol es poden utilitzar com a prova ràpida i senzilla, però les varietats més econòmiques no sempre proporcionen una mesura precisa de la força de la solució.
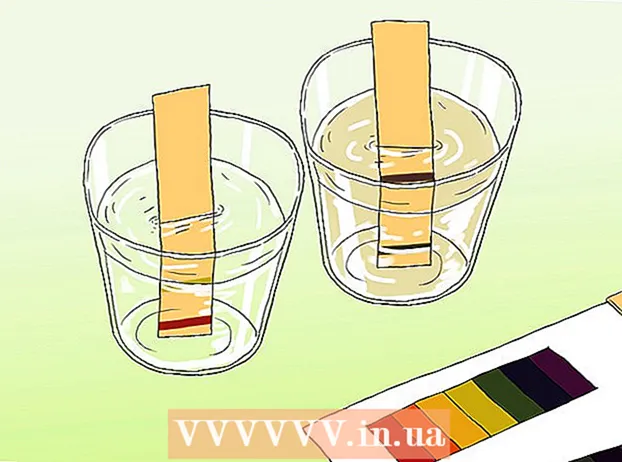
 Agafeu una mostra de l'aigua i aboqueu-la a un recipient net. L’aigua ha de ser prou profunda per submergir la tira.
Agafeu una mostra de l'aigua i aboqueu-la a un recipient net. L’aigua ha de ser prou profunda per submergir la tira.  Immergiu una tira reactiva a la mostra. L’exposició d’uns segons és suficient. Les barres indicadores del paper canviaran de color al cap d’uns instants.
Immergiu una tira reactiva a la mostra. L’exposició d’uns segons és suficient. Les barres indicadores del paper canviaran de color al cap d’uns instants.  Compareu el final de la tira reactiva amb el gràfic de colors que s’inclou amb el paper. El color o els colors de la targeta han de coincidir amb el color o els colors de la tira de prova. El mapa de colors relaciona els patrons de color amb els nivells de pH.
Compareu el final de la tira reactiva amb el gràfic de colors que s’inclou amb el paper. El color o els colors de la targeta han de coincidir amb el color o els colors de la tira de prova. El mapa de colors relaciona els patrons de color amb els nivells de pH.
Mètode 3 de 3: comprensió del pH
 Apreneu com es defineixen els àcids i les bases. Acidesa i alcalinitat (el terme utilitzat per descriure les bases) es defineixen ambdós ions d’hidrogen que donen o que prenen. Un àcid és una substància que dona (o "dona") ions hidrogen, i una base és una substància que absorbeix ions hidrogen addicionals.
Apreneu com es defineixen els àcids i les bases. Acidesa i alcalinitat (el terme utilitzat per descriure les bases) es defineixen ambdós ions d’hidrogen que donen o que prenen. Un àcid és una substància que dona (o "dona") ions hidrogen, i una base és una substància que absorbeix ions hidrogen addicionals.  Comprendre l’escala de pH. El número de pH s’utilitza per mesurar el grau d’acidesa o alcalinitat de les substàncies solubles en aigua. L’aigua té normalment la mateixa quantitat d’ions hidròxid (OH−) i ions hidroni (H3O +). La proporció d’ions hidròxid i hidroni canvia quan s’afegeix a l’aigua una substància àcida o alcalina.
Comprendre l’escala de pH. El número de pH s’utilitza per mesurar el grau d’acidesa o alcalinitat de les substàncies solubles en aigua. L’aigua té normalment la mateixa quantitat d’ions hidròxid (OH−) i ions hidroni (H3O +). La proporció d’ions hidròxid i hidroni canvia quan s’afegeix a l’aigua una substància àcida o alcalina. - Normalment es considera una escala que oscil·la entre 0 i 14 (tot i que les substàncies poden quedar fora d’aquest rang). Les substàncies neutres són de 7, les àcides són inferiors a 7 i les alcalines superen els 7.
- L’escala de pH és logarítmica, el que significa que les diferències enteres representen una diferència de deu vegades en acidesa o alcalinitat. Per exemple, una substància amb un pH de 2 és deu vegades més àcida que una substància amb un pH de 3 i 100 vegades més àcida que una substància amb un pH de 4. L’escala funciona de la mateixa manera amb substàncies alcalines, amb qualsevol l’ésser enter representa una diferència en deu.
 Esbrineu per què provem el pH de l’aigua. L’aigua pura té un pH de 7, però l’aigua de l’aixeta holandesa sol tenir un pH d’entre 7,5 i 8,3. És més probable que l'aigua molt àcida (aigua amb un valor de pH baix) dissolgui productes químics tòxics. Aquests poden contaminar l'aigua i fer que sigui poc segur per beure.
Esbrineu per què provem el pH de l’aigua. L’aigua pura té un pH de 7, però l’aigua de l’aixeta holandesa sol tenir un pH d’entre 7,5 i 8,3. És més probable que l'aigua molt àcida (aigua amb un valor de pH baix) dissolgui productes químics tòxics. Aquests poden contaminar l'aigua i fer que sigui poc segur per beure. - En general, es recomana provar el pH in situ. Si es pren una mostra d’aigua per a la investigació de laboratori, el diòxid de carboni (CO2) de l’aire es pot dissoldre a l’aigua. El diòxid de carboni dissolt reacciona amb els ions de l’aigua i augmenta l’acidesa en solucions bàsiques o neutres. Per evitar la contaminació amb diòxid de carboni, l’aigua s’ha de provar dins de les dues hores posteriors a la recollida.



