Autora:
Lewis Jackson
Data De La Creació:
8 Ser Possible 2021
Data D’Actualització:
25 Juny 2024
Content
L’equació iònica neta és una part important de la química perquè només representa les partícules que canvien en una reacció química. S’utilitzen més comunament en reaccions d’oxidació-reducció, reaccions metabòliques i reaccions de neutralització d’àcids-bases. Hi ha tres passos bàsics per escriure una equació iònica neta: equilibrar l’equació molecular, convertir-la a l’equació iònica completa (segons com existeix cada substància en solució) i, finalment, escriure l’equació iònica neta.
Passos
Part 1 de 2: Comprensió dels components de l’equació iònica
Conèixer la diferència entre molècules i compostos iònics. El primer pas per escriure una equació iònica neta és determinar els compostos iònics de la reacció. Els compostos iònics són aquells que dissocien els ions en una solució aquosa i tenen una càrrega elèctrica. Els compostos moleculars són compostos que mai no tenen càrrega elèctrica. Es formen entre dos no metàl·lics i de vegades es coneixen com a compostos covalents.
- Els compostos iònics es poden formar entre metalls i no metalls, metalls i ions poliatòmics, o múltiples ions poliatòmics.
- Si no esteu segur de quin és el compost, podeu cercar els elements d’aquest compost a la taula periòdica.

Reconèixer la solubilitat d’un compost. No tots els compostos iònics són solubles en solució aquosa, de manera que no es poden dissociar en ions. Heu d’identificar la solubilitat de cada compost abans de continuar amb la resta de l’equació. A continuació es mostra un resum de les regles de solubilitat. Cerqueu un full de càlcul de solubilitat per obtenir informació més detallada i excepcions a aquestes regles.- Seguiu aquestes regles en l'ordre que es descriu a continuació:
- Totes les sals de Na, K i NH4 tot es fon.
- Totes SENSE sals3, C2H3O2, ClO3, i ClO4 tot es fon.
- Totes les sals d’Ag, Pb i Hg2 tot es fon.
- Totes les sals de Cl, Br i I són solubles.
- Totes les sals de CO3, O, S, OH, PO4, CrO4, Cr2O7, i així3 tots es dissolen (excepte en alguns casos).
- Totes les sals SO4 es dissolen (excepte en alguns casos).
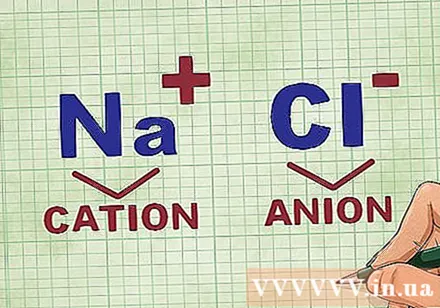
Determinació de cations i anions en un compost. Els cations són els ions positius d’un compost i solen ser el metall. L’anió és l’ió negatiu del compost i no és metàl·lic. Alguns no metalls poden formar cations, però els metalls sempre formen cations.- Per exemple, en NaCl, Na és el catió carregat positivament perquè és un metall i Cl és l'anió carregat negativament perquè no és metàl·lic.

Reconèixer els ions poliatòmics de la reacció. Els ions poliatòmics són molècules carregades que s’uneixen estretament i no es dissocien durant les reaccions químiques. És important reconèixer els ions poliatòmics perquè tenen una càrrega específica i no es dissocien. Els ions poliatòmics poden tenir una càrrega positiva o negativa.- Si esteu estudiant química general, sovint cal que recordeu alguns ions poliatòmics comuns.
- Alguns ions poliatòmics comuns són CO3, NO3, NO2, TAN4, TAN3, ClO4 i ClO3.
- També podeu trobar molts altres ions en llibres de química o a Internet.
Part 2 de 2: Escriure una equació iònica neta
Equacions moleculars d'equilibri. Abans d’escriure una equació iònica neta, heu d’assegurar-vos que la vostra equació molecular estigui equilibrada. Per equilibrar l’equació, afegiu coeficients davant del compost de manera que el nombre atòmic de cada element sigui igual a banda i banda de l’equació.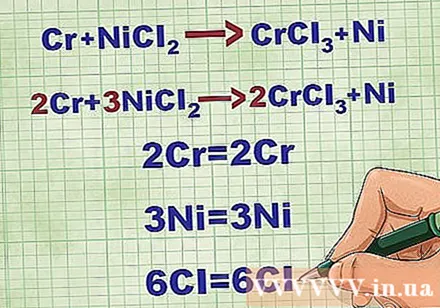
- Escriviu el nombre d’àtoms que formen cada compost a banda i banda de l’equació.
- Afegiu un coeficient davant d’elements diferents de l’oxigen i l’hidrogen per equilibrar cada costat.
- Equilibri d’àtoms d’hidrogen.
- Equilibri atòmic d’oxigen.
- Recompteu el nombre d’àtoms a cada costat de l’equació per assegurar-vos que estiguin equilibrats.
- Per exemple, Cr + NiCl2 -> CrCl3 + Ni Equilibrat a 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Identifiqueu l’estat del compost a l’equació. Moltes vegades en el problema hi ha paraules clau que us permeten conèixer l’estat de cada compost. Hi ha diverses regles per ajudar a determinar l’estat d’un element o compost.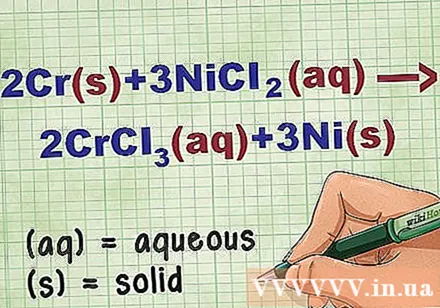
- Si no es proporciona cap estat per a l'element, utilitzeu l'estat que es troba a la taula periòdica.
- Si el compost s’anomena solució, podeu escriure’l com a aquós o (dd).
- Si hi ha aigua a l’equació, heu de determinar si el compost iònic és soluble en aigua mitjançant el full de càlcul de solubilitat. Si la solubilitat és elevada, el compost serà aquós (dd), si la solubilitat és baixa, el compost serà sòlid (r).
- Sense aigua, el compost iònic és sòlid (r).
- Si el problema és àcid o bàsic, el compost és aquós (dd).
- Per exemple, 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Les formes elementals de Cr i Ni es troben en estat sòlid. NiCl2 i CrCl3 els compostos iònics són solubles, de manera que són aquosos. Torneu a escriure l’equació com: 2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Determineu quins compostos es dissociaran (dissociaran en cations i anions) en solució. Quan una substància o compost es dissocia, es dissocia en un ió carregat positivament (catió) i un ió carregat negativament (anió). Aquests són els components que s’equilibraran al final de l’equació iònica neta.
- Sòlids, líquids, gasos, compostos moleculars, compostos iònics de baixa solubilitat, ions poliatòmics i àcids febles no es dissociaran.
- Els compostos iònics tenen una alta solubilitat (utilitzeu la taula de solubilitat) i els àcids forts s’ionitzaran al 100% (HCl(dd), HBr(dd), HI(dd), H2TAN4(dd), HClO4(dd), i HNO3(dd)).
- Tingueu en compte que, tot i que els ions poliatòmics ja no es dissocien, si són components d’aquest compost, es dissocien del compost.
Calculeu la càrrega de cada ió dissociat del compost. Recordeu que els metalls formaran ions positius i que els no metalls formaran ions negatius. Utilitzeu la taula periòdica per determinar la càrrega d’un element. També heu d’equilibrar la càrrega de cada ió del compost.
- En aquest exemple, NiCl2 dissociat en Ni i Cl mentre que CrCl3 dividit en Cr i Cl.
- Ni té una càrrega de 2+ perquè Cl té una càrrega de negativa però té 2 àtoms. Per tant, hem d’equilibrar els 2 ions Cl negatius. Cr té una càrrega superior a 3, de manera que hem d’equilibrar els 3 ions Cl negatius.
- Recordeu que els ions poliatòmics tenen una càrrega específica.
Anota l’equació iònica completa. Tot el que dissoci o ionitzi (àcids forts) es separa en dos ions separats. L’estat de la substància es manté (dd), però assegureu-vos que l’equació continua equilibrada.
- Els sòlids, líquids, gasos, àcids febles i compostos iònics de baixa solubilitat no canvien d'estat ni se separen en ions. Els mantenim intactes.
- Les substàncies moleculars es dispersaran en solució de manera que el seu estat canviï a (dd). Tres excepcions no ho són convertir-se en (dd) és: CH4(k), C3H8(k)i C8H18(l).
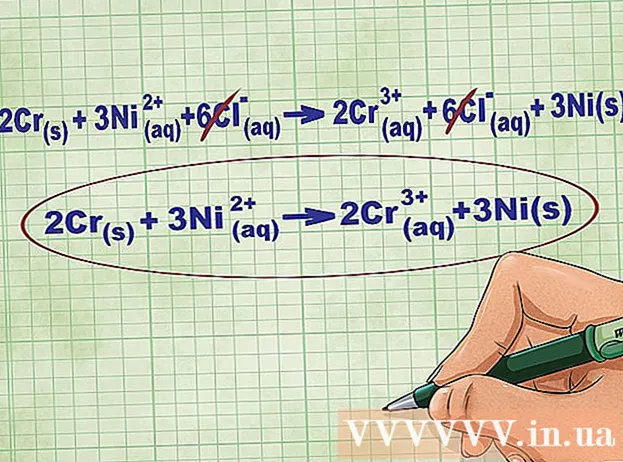
- Seguint amb l'exemple anterior, l'equació iònica completa té aquest aspecte: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r). Quan Cl no es troba en un compost, no és un bipolar, de manera que multipliquem el factor pel nombre d’àtoms del compost per obtenir 6 ions Cl a banda i banda de l’equació.
Elimineu els ions d’equilibri cancel·lant els mateixos ions a cada costat de l’equació. Només es pot cancel·lar si són exactament iguals a banda i banda (càrrega, nombre atòmic, etc.). Torneu a escriure l’equació sense les substàncies destructibles.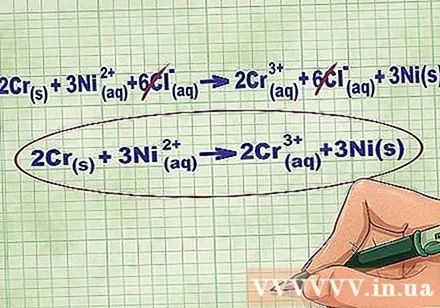
- Després de completar l'exemple, tenim 6 ions d'equilibri Cl cancel·lables a cada costat. L’equació iònica neta és 2Cr(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- Si teniu raó, la càrrega total del costat reactiu hauria de ser igual a la càrrega total del costat del producte a l’equació iònica neta.
Consells
- Escriviu els estats de totes les substàncies a l’equació, si no vosaltres voluntat perdre punts.