Autora:
Lewis Jackson
Data De La Creació:
6 Ser Possible 2021
Data D’Actualització:
24 Juny 2024
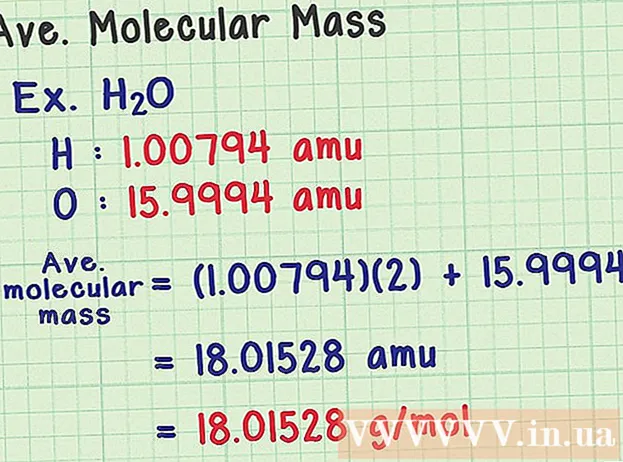
Content
L’àtom de massa mitjà no és una mesura directa de la massa d’un àtom. En canvi, aquesta és la massa mitjana per àtom d'una mostra típica de l'element. Si podeu mesurar les masses de milers de milions d’àtoms individuals, podeu esbrinar-ho calculant la seva mitjana. Tenim un mètode més pràctic, que es basa en informació sobre els diferents isòtops de l’element químic.
Passos
Part 1 de 2: Calculeu l'àtom de massa mitjà
Comprendre els isòtops i els àtoms de massa. A la natura, la majoria dels elements existeixen de moltes formes o isòtops. L’única diferència entre dos isòtops d’un mateix element és el nombre de neutrons de l’àtom, el nombre de neutrons del qual afecta l’àtom de massa. El càlcul de l'àtom de massa mitjana té en compte l'efecte d'aquesta diferència i us indica la massa mitjana de cada àtom en una mostra d'aquests àtoms.
- Per exemple, l’element plata (Ag) té dos isòtops naturals: Ag-107 i Ag-109 (o Ag i Ag). L'isòtop rep el nom del "nombre de massa", o la suma del nombre de protons i del nombre de neutrons en un àtom. Això significa que l'Ag-109 té dos neutrons més que l'Ag-107, de manera que el seu àtom és una mica més pesat.

Trobeu la massa de cada isòtop. Necessiteu dues informacions per a cada isòtop, les podeu cercar en llibres de consulta o buscar en línia, per exemple webelements.com. El primer és l'àtom de massa o massa atòmica de cada isòtop. Els isòtops amb més neutrons tenen més massa.- Per exemple, l’isòtop de plata Ag-107 té l’àtom de massa 106.90509 amu (la unitat d’un àtom cúbic). L'isòtop Ag-109 és una mica més pesat amb una massa de 108,90470.
- El parell de decimals al final pot ser lleugerament diferent en els documents. No escriviu cap número entre parèntesis després de la missa.

Anoteu la taxa de supervivència natural de cada isòtop. Aquesta proporció indica la prevalença de l’isòtop, com a percentatge dels àtoms totals de l’element. Podeu trobar aquesta informació al mateix document amb un àtom cúbic. La supervivència natural de tots els isòtops ha de ser del 100% (tot i que pot diferir lleugerament a causa de l’error d’arrodoniment).- L’isòtop Ag-107 té una proporció del 51,86%. L’isòtop Ag-109 és menys comú a un ritme del 48,14%. Això significa que una mostra de plata normal té un 51,86% d’Ag-107 i un 48,14% d’Ag-109.
- S’ignoren tots els isòtops que no tinguin aquesta taxa de supervivència. Aquests isòtops no existeixen de forma natural a la terra.

Convertiu el percentatge d’isòtops en un nombre decimal. Dividir aquesta proporció per 100 obtindrà el mateix valor que un decimal.- A la mostra de plata anterior, la proporció d’isòtops és de 51,86 / 100 = 0,5186 i 48,14 / 100 = 0,4814.
Trobeu l’àtom cúbic mitjà. L’àtom de massa mitjà d’un element té n isòtops iguals (Bloc atòmicIsòtop 1 relació *Isòtop 1) + (massa atòmicaIsòtop 2 relació *Isòtop 2) + ... + (massa atòmicaisòtops n relació *isòtops n. Aquest és un exemple de "massa mitjana", és a dir, com més gran sigui la taxa de supervivència de l'isòtop, major serà el seu efecte sobre el resultat. Com aplicar aquesta fórmula per a la plata és el següent:
- Àtom de massa mitjanaAg = (àtom cúbicAg-107 relació *Ag-107) + (massa atòmicaAg-109 relació *Ag-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107.8677 amu. - Cerqueu aquest element a la taula periòdica per comprovar els resultats. L’àtom cúbic mitjà s’escriu sempre a sota del símbol químic de l’element.
- Àtom de massa mitjanaAg = (àtom cúbicAg-107 relació *Ag-107) + (massa atòmicaAg-109 relació *Ag-109)
Part 2 de 2: Ús de resultats
Converteix la massa en nombre atòmic. L’àtom de massa mitjà mostra la relació entre la massa i el nombre d’àtoms en una mostra típica d’aquest element. Això és molt útil en laboratoris químics perquè és gairebé impossible comptar amb precisió els àtoms, però les masses són fàcils de determinar. Per exemple, podeu pesar una mostra de plata i saber que hi haurà un àtom de plata per cada 107.8677 amu.
Converteix en massa molar. La unitat de massa atòmica és molt petita, de manera que els químics solen utilitzar la unitat de gram per a la massa. Per sort, tenim definicions d’aquests conceptes, de manera que la transformació hauria de ser fàcil. Simplement multipliqueu l'àtom de massa mitjà per 1 g / mol (constant de massa molar) per obtenir un resultat en g / mol. Per exemple, 107.8677 grams de plata contenen un mol d’àtoms de plata.
Trobeu la massa molecular mitjana. Com que una molècula és una col·lecció d’àtoms, podeu afegir la massa de tots els àtoms per trobar la massa molecular. Si utilitzeu un àtom de massa mitjà (en lloc de la massa d’un isòtop concret), el resultat serà la massa molecular mitjana d’una mostra a la natura. Aquí teniu un exemple:
- Una molècula d’aigua té la fórmula química H2O conté dos àtoms d’hidrogen (H) i un d’oxigen (O).
- L’hidrogen té un àtom de massa mitjà de 1.00794 amu. L’oxigen té una massa atòmica mitjana de 15.9994 amu.
- Per tant, la massa molecular mitjana d’H2O és igual a (1.00794) (2) + 15.9994 = 18.01528 amu, que equival a 18.01528 g / mol.
Consells
- El concepte de massa atòmica relativa s'utilitza de vegades sinònim d'un àtom de massa mitjana. Hi ha una lleugera diferència perquè la massa atòmica és relativament baixa; és una mesura de la massa relativa a un àtom de carboni-12. Sempre que utilitzeu la unitat de massa atòmica en el càlcul mitjà d’àtoms cúbics, aquests dos valors són els mateixos.
- El nombre entre parèntesis després de l'àtom cúbic ens indica l'error. Per exemple, l'àtom de massa 1.0173 (4) significa que l'àtom normal de l'element té un rang de massa d'aproximadament 1.0173 ± 0.0004. No cal obtenir aquest número si no se’l sol·licita.
- A la taula periòdica, l’àtom cúbic mitjà de l’element següent és més gran que l’anterior, amb poques excepcions. Aquí teniu una manera ràpida de comprovar els vostres resultats.
- 1 unitat de massa atòmica és 1/12 de la massa d'un àtom de carboni-12.
- Les taxes de supervivència dels isòtops es calculen d’acord amb mostres típiques de naturalesa a la terra. Les substàncies no naturals com els meteorits o una produïda en un laboratori poden tenir relacions d’isòtops diferents, de manera que l’àtom de massa mitjana també és diferent.
Advertiment
- Els àtoms de massa s’escriuen sempre en unitats de massa atòmica (amu o u), de vegades anomenades daltons (Da). Mai no escriviu una altra unitat de massa (com ara un quilogram) després d’aquest número sense canviar-lo.
Què necessites
- Llapis
- Paper
- Portàtil
- Dades sobre la taxa de supervivència dels isòtops a la natura.
- Dades de la unitat atòmica de massa per als isòtops.