Autora:
Sara Rhodes
Data De La Creació:
12 Febrer 2021
Data D’Actualització:
1 Juliol 2024
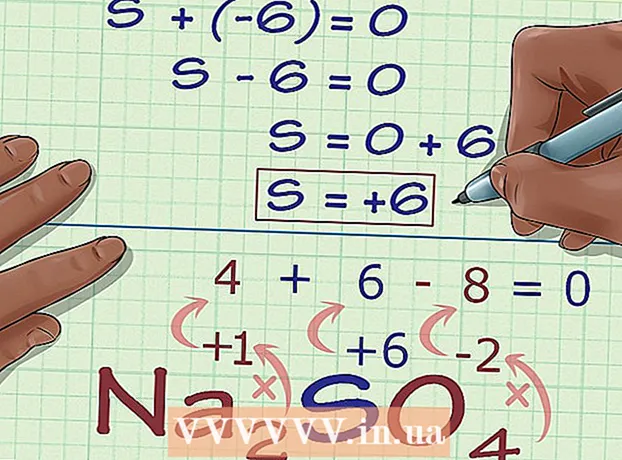
Content
- Passos
- Part 1 de 2: Determinació de l'estat d'oxidació segons les lleis de la química
- Part 2 de 2: Determinar l'estat d'oxidació sense utilitzar les lleis de la química
- Consells
- Què necessites
En química, els termes "oxidació" i "reducció" signifiquen reaccions en què un àtom o un grup d'àtoms perden o, respectivament, guanyen electrons. L’estat d’oxidació és un valor numèric assignat a un o més àtoms que caracteritza el nombre d’electrons redistribuïts i mostra com es distribueixen aquests electrons entre els àtoms durant una reacció. La determinació d'aquest valor pot ser un procediment senzill i bastant complex, en funció dels àtoms i de les molècules que els componen. A més, els àtoms d’alguns elements poden tenir diversos estats d’oxidació. Afortunadament, hi ha regles senzilles inequívocs per determinar l’estat d’oxidació, per a l’ús segur de les quals és suficient conèixer els fonaments de la química i l’àlgebra.
Passos
Part 1 de 2: Determinació de l'estat d'oxidació segons les lleis de la química
 1 Determineu si la substància en qüestió és elemental. L’estat d’oxidació dels àtoms fora d’un compost químic és nul. Aquesta regla és certa tant per a substàncies formades a partir d’àtoms lliures separats com per a aquelles que consisteixen en dues molècules poliatòmiques d’un element.
1 Determineu si la substància en qüestió és elemental. L’estat d’oxidació dels àtoms fora d’un compost químic és nul. Aquesta regla és certa tant per a substàncies formades a partir d’àtoms lliures separats com per a aquelles que consisteixen en dues molècules poliatòmiques d’un element. - Per exemple, Al(s) i Cl2 tenen un estat d’oxidació de 0, ja que tots dos es troben en un estat elemental químicament no lligat.
- Tingueu en compte que la forma al·lotròpica del sofre S8, o octacera, tot i la seva estructura atípica, també es caracteritza per un estat d’oxidació zero.
 2 Determineu si la substància en qüestió està composta per ions. L’estat d’oxidació dels ions és igual a la seva càrrega. Això és cert tant per als ions lliures com per als que formen part dels compostos químics.
2 Determineu si la substància en qüestió està composta per ions. L’estat d’oxidació dels ions és igual a la seva càrrega. Això és cert tant per als ions lliures com per als que formen part dels compostos químics. - Per exemple, l’estat d’oxidació de l’ió Cl és -1.
- L’estat d’oxidació de l’ió Cl en el compost químic NaCl és també -1. Com que l’ió Na, per definició, té una càrrega de +1, arribem a la conclusió que la càrrega de l’ió Cl és -1 i, per tant, el seu estat d’oxidació és -1.
 3 Tingueu en compte que els ions metàl·lics poden tenir diversos estats d’oxidació. Els àtoms de molts elements metàl·lics poden ionitzar-se en quantitats diferents. Per exemple, la càrrega iònica d’un metall com el ferro (Fe) és +2 o +3. La càrrega dels ions metàl·lics (i el seu estat d'oxidació) es pot determinar per les càrregues dels ions d'altres elements amb què aquest metall forma part d'un compost químic; al text, aquesta càrrega es denota amb números romans: per exemple, el ferro (III) té un estat d’oxidació de +3.
3 Tingueu en compte que els ions metàl·lics poden tenir diversos estats d’oxidació. Els àtoms de molts elements metàl·lics poden ionitzar-se en quantitats diferents. Per exemple, la càrrega iònica d’un metall com el ferro (Fe) és +2 o +3. La càrrega dels ions metàl·lics (i el seu estat d'oxidació) es pot determinar per les càrregues dels ions d'altres elements amb què aquest metall forma part d'un compost químic; al text, aquesta càrrega es denota amb números romans: per exemple, el ferro (III) té un estat d’oxidació de +3. - Com a exemple, considerem un compost que conté un ió d'alumini. Càrrega total de compost AlCl3 és zero.Com que sabem que els ions Cl tenen una càrrega de -1 i que el compost conté 3 ions d’aquest tipus, per a la neutralitat general de la substància en qüestió, l’ió Al ha de tenir una càrrega de +3. Així, en aquest cas, l’estat d’oxidació de l’alumini és de +3.
 4 L’estat d’oxidació de l’oxigen és -2 (amb algunes excepcions). En gairebé tots els casos, els àtoms d’oxigen tenen un estat d’oxidació de -2. Hi ha diverses excepcions a aquesta regla:
4 L’estat d’oxidació de l’oxigen és -2 (amb algunes excepcions). En gairebé tots els casos, els àtoms d’oxigen tenen un estat d’oxidació de -2. Hi ha diverses excepcions a aquesta regla: - Si l’oxigen es troba en estat elemental (O2), el seu estat d’oxidació és 0, com en el cas d’altres substàncies elementals.
- Si forma part de l’oxigen peròxid, el seu estat d’oxidació és -1. Els peròxids són un grup de compostos que contenen un simple enllaç oxigen-oxigen (és a dir, l’anió peròxid d’O2). Per exemple, en la composició de l’H2O2 (peròxid d’hidrogen) l’oxigen té un estat de càrrega i oxidació de -1.
- Quan es combina amb el fluor, l’oxigen té un estat d’oxidació de +2, llegiu la regla següent sobre el fluor.
 5 L’hidrogen té un estat d’oxidació de +1, amb algunes excepcions. Igual que amb l’oxigen, també hi ha excepcions. Com a regla general, l’estat d’oxidació de l’hidrogen és +1 (si no es troba en l’estat elemental H2). Tanmateix, en els compostos anomenats hidrurs, l’estat d’oxidació de l’hidrogen és -1.
5 L’hidrogen té un estat d’oxidació de +1, amb algunes excepcions. Igual que amb l’oxigen, també hi ha excepcions. Com a regla general, l’estat d’oxidació de l’hidrogen és +1 (si no es troba en l’estat elemental H2). Tanmateix, en els compostos anomenats hidrurs, l’estat d’oxidació de l’hidrogen és -1. - Per exemple, a H2O L’estat d’oxidació de l’hidrogen és +1 perquè l’àtom d’oxigen té una càrrega de -2 i es necessiten dues càrregues de +1 per a la neutralitat general. No obstant això, en la composició de l’hidrid de sodi, l’estat d’oxidació de l’hidrogen ja és -1, ja que l’ió Na té una càrrega de +1 i, per a l’electronutralitat general, la càrrega de l’àtom d’hidrogen (i, per tant, el seu estat d’oxidació) hauria de ser ser -1.
 6 Fluor sempre té un estat d’oxidació de -1. Com ja es va assenyalar, l'estat d'oxidació d'alguns elements (ions metàl·lics, àtoms d'oxigen en peròxids, etc.) pot variar en funció d'una sèrie de factors. L’estat d’oxidació del fluor, però, és invariablement -1. Això es deu al fet que aquest element té la major electronegativitat, és a dir, que els àtoms de fluor són els menys disposats a separar-se dels seus propis electrons i a atraure els electrons de manera més activa. Per tant, el seu càrrec es manté inalterat.
6 Fluor sempre té un estat d’oxidació de -1. Com ja es va assenyalar, l'estat d'oxidació d'alguns elements (ions metàl·lics, àtoms d'oxigen en peròxids, etc.) pot variar en funció d'una sèrie de factors. L’estat d’oxidació del fluor, però, és invariablement -1. Això es deu al fet que aquest element té la major electronegativitat, és a dir, que els àtoms de fluor són els menys disposats a separar-se dels seus propis electrons i a atraure els electrons de manera més activa. Per tant, el seu càrrec es manté inalterat.  7 La suma dels estats d’oxidació d’un compost és igual a la seva càrrega. Els estats d’oxidació de tots els àtoms que formen un compost químic s’han de sumar a la càrrega d’aquest compost. Per exemple, si un compost és neutre, la suma dels estats d’oxidació de tots els seus àtoms hauria de ser nul·la; si el compost és un ió poliatòmic amb una càrrega de -1, la suma dels estats d’oxidació és -1, etc.
7 La suma dels estats d’oxidació d’un compost és igual a la seva càrrega. Els estats d’oxidació de tots els àtoms que formen un compost químic s’han de sumar a la càrrega d’aquest compost. Per exemple, si un compost és neutre, la suma dels estats d’oxidació de tots els seus àtoms hauria de ser nul·la; si el compost és un ió poliatòmic amb una càrrega de -1, la suma dels estats d’oxidació és -1, etc. - Aquest és un bon mètode de prova: si la suma dels estats d’oxidació no és igual a la càrrega total del compost, llavors s’equivoca en algun lloc.
Part 2 de 2: Determinar l'estat d'oxidació sense utilitzar les lleis de la química
 1 Cerqueu àtoms que no tinguin regles estrictes sobre el seu estat d’oxidació. Per a alguns elements, no hi ha regles fermament establertes per trobar l’estat d’oxidació. Si un àtom no s’ajusta a cap de les regles enumerades anteriorment i no en coneixeu la càrrega (per exemple, l’àtom forma part d’un complex i no s’especifica la seva càrrega), podeu determinar l’estat d’oxidació d’un àtom d’aquest tipus. per exclusió. Primer, determineu la càrrega de tots els altres àtoms del compost i, a continuació, a partir de la càrrega total coneguda del compost, calculeu l’estat d’oxidació d’aquest àtom.
1 Cerqueu àtoms que no tinguin regles estrictes sobre el seu estat d’oxidació. Per a alguns elements, no hi ha regles fermament establertes per trobar l’estat d’oxidació. Si un àtom no s’ajusta a cap de les regles enumerades anteriorment i no en coneixeu la càrrega (per exemple, l’àtom forma part d’un complex i no s’especifica la seva càrrega), podeu determinar l’estat d’oxidació d’un àtom d’aquest tipus. per exclusió. Primer, determineu la càrrega de tots els altres àtoms del compost i, a continuació, a partir de la càrrega total coneguda del compost, calculeu l’estat d’oxidació d’aquest àtom. - Per exemple, en el compost Na2TAN4 la càrrega de l'àtom de sofre (S) és desconeguda: només sabem que no és nul·la, ja que el sofre no es troba en un estat elemental. Aquest compost serveix de bon exemple per il·lustrar el mètode algebraic per determinar l’estat d’oxidació.
 2 Trobeu els estats d’oxidació dels elements restants del compost. Utilitzant les regles descrites anteriorment, determineu els estats d’oxidació dels àtoms restants del compost. No us oblideu de les excepcions a la regla per a O, H, etc.
2 Trobeu els estats d’oxidació dels elements restants del compost. Utilitzant les regles descrites anteriorment, determineu els estats d’oxidació dels àtoms restants del compost. No us oblideu de les excepcions a la regla per a O, H, etc. - Per a Na2TAN4, utilitzant les nostres regles, trobem que la càrrega (i, per tant, l’estat d’oxidació) de l’ió Na és +1, i per a cadascun dels àtoms d’oxigen és -2.
 3 Multiplicar el nombre d’àtoms pel seu estat d’oxidació. Ara que coneixem els estats d’oxidació de tots els àtoms excepte d’un, cal tenir en compte que poden haver-hi diversos àtoms d’alguns elements. Multiplicar el nombre d’àtoms de cada element (s’indica a la fórmula química del compost com a subíndex seguint el símbol de l’element) pel seu estat d’oxidació.
3 Multiplicar el nombre d’àtoms pel seu estat d’oxidació. Ara que coneixem els estats d’oxidació de tots els àtoms excepte d’un, cal tenir en compte que poden haver-hi diversos àtoms d’alguns elements. Multiplicar el nombre d’àtoms de cada element (s’indica a la fórmula química del compost com a subíndex seguint el símbol de l’element) pel seu estat d’oxidació. - A Na2TAN4 tenim 2 àtoms de Na i 4 àtoms d’O. Així, multiplicant 2 × +1, obtenim l’estat d’oxidació de tots els àtoms de Na (2) i multiplicant 4 × -2, l’estat d’oxidació dels àtoms d’O (-8).
 4 Sumeu els resultats anteriors. Resumint els resultats de la multiplicació, obtenim l’estat d’oxidació del compost sense tenint en compte la contribució de l'àtom desitjat.
4 Sumeu els resultats anteriors. Resumint els resultats de la multiplicació, obtenim l’estat d’oxidació del compost sense tenint en compte la contribució de l'àtom desitjat. - En el nostre exemple, per a Na2TAN4 afegim 2 i -8 i obtenim -6.
 5 Trobeu l’estat d’oxidació desconegut a partir de la càrrega del compost. Ara teniu totes les dades per calcular fàcilment l’estat d’oxidació desitjat. Anoteu una equació, a la part esquerra de la qual hi haurà la suma del nombre obtingut en el pas anterior de càlcul i l’estat d’oxidació desconegut, i a la part dreta de la càrrega total del compost. En altres paraules, (Suma d'estats d'oxidació coneguts) + (estat d'oxidació desitjat) = (càrrega d'un compost).
5 Trobeu l’estat d’oxidació desconegut a partir de la càrrega del compost. Ara teniu totes les dades per calcular fàcilment l’estat d’oxidació desitjat. Anoteu una equació, a la part esquerra de la qual hi haurà la suma del nombre obtingut en el pas anterior de càlcul i l’estat d’oxidació desconegut, i a la part dreta de la càrrega total del compost. En altres paraules, (Suma d'estats d'oxidació coneguts) + (estat d'oxidació desitjat) = (càrrega d'un compost).- En el nostre cas, Na2TAN4 la solució té aquest aspecte:
- (Suma d'estats d'oxidació coneguts) + (estat d'oxidació desitjat) = (càrrega composta)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2TAN4 el sofre té un estat d’oxidació 6.
- En el nostre cas, Na2TAN4 la solució té aquest aspecte:
Consells
- En els compostos, la suma de tots els estats d’oxidació ha de ser igual a la càrrega. Per exemple, si el compost és un ió diatòmic, la suma dels estats d’oxidació dels àtoms ha de ser igual a la càrrega iònica total.
- És molt útil poder utilitzar la taula periòdica i saber on es troben els elements metàl·lics i no metàl·lics.
- L’estat d’oxidació dels àtoms en forma elemental sempre és nul. L’estat d’oxidació d’un sol ió és igual a la seva càrrega. Els elements del grup 1A de la taula periòdica, com l’hidrogen, el liti, el sodi, en forma elemental tenen un estat d’oxidació de +1; L’estat d’oxidació dels metalls del grup 2A, com el magnesi i el calci, és de +2 en forma elemental. L’oxigen i l’hidrogen, segons el tipus d’enllaç químic, poden tenir 2 estats d’oxidació diferents.
Què necessites
- Taula periòdica d'elements
- Llibres de consulta d’accés a Internet o química
- Un full de paper, bolígraf o llapis
- Calculadora